Johdanto
Posteriorinen reversiibeli enkefalopatiaoireyhtymä (PRES) on harvinainen komplikaatio useille kliinisille kokonaisuuksille. Sen esiintyvyyttä ei tunneta, ja siitä on ilmoitettu monenlaisissa ikäryhmissä 14–78 vuotta, keski-ikä 44 vuotta ja miesten ja naisten suhde 0,8 / 1,1. Vaikka ennuste on yleensä suotuisa, kuolleisuusaste on jopa 15 % on raportoitu.2 Sen määrää tyypilliset kliiniset ja radiologiset oireet, yleensä ohimenevät.3 Joko akuutissa tai subakuutissa muodossa, taajuuden alenevassa järjestyksessä se esiintyy enkefalopatian, kouristuskohtausten, päänsäryn, näköhäiriöiden ja fokaalisen neurologisen alijäämän kanssa.4 Useita patofysiologisia teorioita on oletettu, joista kaksi on hyväksyttävimpiä. Ensimmäinen viittaa siihen, että äkillinen verenpaineen nousu ylittää aivoverenkierron itsesääntelyn aiheuttaen verisuonten laajenemisen ja hyperperfuusion sekä veren ja aivojen esteen (BBB) repeämisen ja vasogeenisen turvotuksen.5 Siten se on liittynyt klassisesti eklampsia ja hypertensiivinen enkefalopatia; kuitenkin 20–30% potilaista on normotensiivisia, mikä viittaa toiseen teoriaan tulehdusvälittäjien aiheuttamasta suorasta endoteelimyrkyllisyydestä, joka korreloi paremmin immunosuppressiivista hoitoa, munuaisten vajaatoimintaa, sidekudoshäiriöitä tai sepsistä sairastavien potilaiden kanssa.6 Sitä esiintyy 7 magneettikuvantamisessa ( Aivojen magneettikuvaus) on diagnoosin kannalta ratkaiseva tekijä, joka osoittaa vasogeenistä turvotusta, yleensä aivojen takaosassa, molemminpuolisesti ja symmetrisesti.8 Koska PRES-diagnoosi vaatii suurta kliinistä ja kuvien epäilystä, minkä jälkeen on aloitettava varhainen hoito suotuisan ennuste; Tämän työn tarkoituksena on antaa tietoa tämän SLE: hen liittyvän epätavallisen oireyhtymän tunnistamiseksi ja hallitsemiseksi.
Tapauksen kuvaus
25-vuotias mestizo-nainen, Quito, Ecuador, jolla on henkilökohtainen patologinen merkitys. kilpirauhasen vajaatoiminnan ja SLE: n ennakkotapaus, diagnosoitu joulukuussa 2012, 21-vuotiaana. Joulukuussa 2016, neljä vuotta SLE: n diagnoosin jälkeen, hän esitteli akuutin ripulitautin aiheuttaman pahenemisen; tuki- ja liikuntaelin- (niveltulehdus, myalgiat) ja limakalvon (suun haavaumat) ilmenemismuodot, serosiitti (oikea pleuraefuusio), bisytopenia (anemia, trombosytopenia), munuaisvaurio (hematuria, proteinuria, akuutti munuaisten vajaatoiminta, akuutti munuaisvammaverkostoluokitus III) ja valtimoverenpainetauti (AHT); jotka kaikki antoivat hänelle korkean SLEDAI-arvon (arvo: 23). Munuaisbiopsia ilmoitti fokuksen proliferatiivisen lupus glomerulonefriitin luokan II, joka ei vastaa voimakasta lupus-aktiivisuutta; ilman fosfolipidien oireyhtymästä johtuvia muutoksia sekä näiden vasta-aineiden negatiivisuutta. Monielinten osallistumisen vuoksi hän sai pulsseina 1 g metyyliprednisolonia laskimonsisäisesti 3 päivän ajan, verituotteiden korvaamista, 6 plasmaperesis-istuntoa, hemodyalisista, amlodipiinia 10 mg / vrk, atenololia 50 mg / vrk ja mykofenolaattimofetiilia 1g / 12h suun kautta, koska hän osoitti ruoansulatuskanavan intoleranssia suuremmille annoksille. Kolme viikkoa pääsyn jälkeen hän osoitti hyväksyttävää analyyttistä ja kliinistä parannusta hoidossa, ja siksi hänen sairaalapoistonsa osoitettiin. 24 tuntia myöhemmin potilas palaa kouristustilassa. Hätätilanteissa he aloittivat hengitysteiden hoidon, laskimonsisäiset kouristuslääkkeet diatsepaamilla 10 mg, midatsolaamilla 3 mg, fenytoiinilla 1 g ja siirtivät hänet tehohoitoyksikölle.
Pyydettiin kallon tomografiaa, jossa ei ollut merkkejä iskemiasta tai verenvuodosta ; havaittiin oikea niskakyhmän hypodensiteetti ilman massavaikutusta, ja tästä syystä tenttien järjestystä laajennettiin sen etiologian tunnistamiseksi. Metaboliset, tarttuvat ja farmakologiset syyt suljettiin pois. Koska vaikeasti hallittavaa AHT: tä (korkeintaan 190/100 mmHg ja keskimääräinen valtimopaine 130 mmHg) potilas tarvitsi jopa 6 verenpainelääkettä; atenololi 50mg / 12h, losartaani 100mg / päivä, amlodipiini 10mg / päivä, doksatsosiini 2mg / 6h nenämahaletkun kautta ja laskimoon annettava nitroprussidi 50mg / päivä ja furosemidi 20mg / 6h. Vakavan lupusaktiivisuuden (SLEDAI 21: kouristukset, hematuria, proteinuria, hypokomplementemia, anti-DNA, trombosytopenia) vuoksi hän sai jälleen hoitoa metyyliprednisolonilla 1 g / 3 päivää. Elektroenkefalogrammi ei osoittanut epileptiformista aktiivisuutta. Se pyysi aivojen angioresonanssia, jossa vaskuliitin tai keskushermoston tromboosin mukaisia löydöksiä ei löytynyt. Aivojen magneettikuvaus osoitti tyypillisiä kuvia PRES: stä (kuva 1), jonka kehitys liittyisi pahenevaan SLE: hen, vaikeaan AHT: hen, lupus glomerulonefriittiin ja immunosuppressanttien käyttöön, joten oraalinen nimodipiini 60 mg / 6h lisättiin ja laukaisutekijöitä kontrolloitiin. .Lääkkeen aiheuttaman lupuksen riskin vuoksi fenytoiini poistettiin vähitellen levetirasetaamin lisääntyessä asteittain tasolle 1 g / 12 h nenämahaletkun kautta. Taulukossa 1 esitetään asiaankuuluvat täydentävät tutkimukset. Seurannan aikana hän ei esittänyt uusia kouristuksia, munuaistoiminta pysyi paikallaan, verenpainearvot paranivat (MAP 85–90 mmHg) ja lupus-aktiivisuus laski (SLEDAI 13: hematuria, proteinuria, hypokomplementemia, anti-DNA , trombosytopenia). Kontrollin aivojen magneettikuvaus osoitti edellisten vaurioiden involionionin (kuva 2).
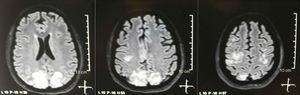
Aivojen yksinkertainen + diffuusioydinmagneettikuvaus aivoissa päästön yhteydessä: kahdenväliset, symmetriset, hyperintenssivauriot FLAIR-sekvenssissä niskakyhmän ja parietaalilohkojen valkea-aineessa.
Tapauskohtaiset täydentävät tutkimukset.
| Päivämäärä | Kliiniset testit |
|---|---|
| SLE: n paheneminen 4 vuotta diagnoosin jälkeen | HB: hemoglobiini 7 mg / dl; hematokriitti 22,2%; verihiutaleet 75 000 / μlC-reaktiivinen proteiini: 2,52 mg / dl; prokalitoniini 0,348 ng / ml kreatiniini 5,7 mg / dl (eGFR CKD-EPI: 9,6 ml / min / 1,73 m2); urea 187 mg / dl Kreatiinikinaasi: 18 U / l; laktaattidehydrogenaasi: 237U / lMU: proteiinit 150 mg / dl; punasolut 40,8 / kenttä; proteinuria: 1452mg / 24hC3: 36mg / dl; C4: 15 mg / dl; anti-dsDNA: 200 IU / ml Lupus-antikoagulantti, kardiolipiinit, beeta-2-glykoproteiini 1: negatiivinen Munuaisten biopsia; fokaalinen lupuksen proliferatiivinen glomerulonefriittiluokka II (ISN / RPS), jonka kroonisuus- ja aktiivisuusindeksi on 4 |
| Takaisinkytkentä | HB: hemoglobiini 8,90mg / dl; hematokriitti 26,3%; verihiutaleet 130 000 / μl Kreatiniini 2,77 mg / dl (eGFR CKD-EPI: 22,8 ml / min / 1,73 m2); urea 105,1 mg / dl Laktaattidehydrogenaasi: 527U / l; y-glutamyylitransferaasi 79U / l; alkalinen fosfataasi: 138 U / l; kokonaisbilirubiini: 1,23 mg / dl; suora: 0,50 mg / dl; epäsuora: 0,73 mg / dlMU: proteiinit 300 mg / dl; punasolut 44 / kenttä; proteinuria 1974mg / 24h Yksinkertainen kallon tomografia: oikea niskakyhmyn hypodensiteetti, ilman massavaikutusta. Ei merkkejä iskemiasta tai verenvuodosta. Kärkipisteiden aaltojen esiintyminen posteriorisilla delta-rytmeillä, pallonpuoliskojen välisellä symmetrialla, ilman paroksismaalista epileptiformista aktiivisuutta Aivojen magneettisen resonanssin angiografia valtimo- ja laskimovaiheessa: ilman verisuonimuutoksia |
anti-dsDNA: anti-kaksijuosteinen DNA; HB: hemaattinen biometria; MU: mikroskooppinen virtsa-analyysi; ISN / RPS: International Society of Nephrology / Renal Pathology Society; SLE: systeeminen lupus erythematosus; eGFR CKD-EPI: glomerulusten suodatusnopeus arvioitu käyttämällä kroonisen munuaissairauden ja epidemiologian yhteistyön yhtälöä.
Keskustelu
PRIN: n ensimmäisen kuvauksen jälkeen, jonka Hinchey ym. tekivät vuonna 1996, tietämys tämän yksikön useista näkökohdista on laajentunut. Sen alkuperäinen nimi palautuva posteriorinen leukoenkefalopatiaoireyhtymä johti epäasianmukaisesti, koska kuvamuutokset eivät aina rajoitu aivojen valkeaan aineeseen eivätkä sen kliiniset oireet ole aina palautuvia.9 Ensimmäiset 15 ilmoitettua tapausta ilmenivät potilailla, joilla oli hypertensiivinen enkefalopatia, eklampsia tai immunosuppressiivinen potilas. hoito.10 Sitä on havaittu myös muiden yksiköiden komplikaationa, kuten sepsis, munuaisten vajaatoiminta ja sidekudoshäiriöt; sen vuoksi tiedetään tällä hetkellä, että endoteelin toimintahäiriöitä aiheuttavat riskitekijät ovat avainasemassa PRES: n kehittymisessä.11 Maailmanlaajuista ilmaantuvuutta ei tiedetä, mutta retrospektiivisten tutkimusten tiedot osoittavat, että se on yleisempää 39–47-vuotiailla, yleensä naiset, joilla on samanaikaisia sairauksia, kuten verenpainetauti, munuaiset tai autoimmuunisairaudet.12 SLE-potilailla monet auto-vasta-aineet kohdistuvat endoteelia vastaan; tuottaa sen aktivaation, adheesiomolekyylien (E-selektiini, VCAM-1, ICAM-1) ilmentymisen ja altistumisen tulehdusta edeltäville sytokiinille, kuten IL-1β, TNFα ja IL-6, aiheuttaen BBB: n häiriöitä ja neurologisten komplikaatioiden ilmaantumisen.13 On raportoitu, että ihmisillä, joilla on diagnosoitu SLE, PRES esiintyy kohtalaisen tai vaikean lupus-aktiivisuuden yhteydessä sekä liittyy munuaisten vajaatoimintaan ja huonosti kontrolloituun hypertensioon.14
PRES: n kliinisten ilmenemismuotojen osalta sille on ominaista vaihteleva enkefalopatian aste sekavuudesta hämmennykseen (50–80%), kohtaukset (60–75%), päänsärky (50%) ja näköhäiriöt, jotka vaihtelevat näön hämärtymisestä kortikaaliseen sokeuteen (33%); Ne ovat epätavallisia fokaalinen neurologinen alijäämä (10–15%) ja epileptinen tila (5–15%) .15 Näiden potilaiden neurologisen kompromissin alustavaan arviointiin vaaditaan yleensä kraniaalinen laskennallinen aksiaalinen tomografia (CT), joka on usein normaali tai voi näyttää aivokuoren ja aivokuoren hypodensiteitä, pääasiassa taka-aivojen alueilla.16 Aivojen magneettikuvaus määrittää diagnoosin, joka osoittaa vasogeenisen turvotuksen, yleensä niskakyhmän ja parietaalilohkojen valkea-aineessa (taka-aivoverenkierron alue). , visualisoitu hyperintensiivisiksi vaurioiksi T2: ssa ja FLAIR: ssä, kahdenvälisiä ja symmetrisiä.17 Valkoisen aineen ensisijainen osallistuminen johtuu sen myelinoitujen kuitujen, arteriolien ja kapillaarien rakenteesta, mikä antaa sille enemmän löyhyyttä. Samoin aivoverenkierron alukset, joilla on suurempi sympaattinen innervaatio, voivat riittävästi reagoida vasokonstriktiolla aivoverenkierron äkilliseen lisääntymiseen verenpaineen seurauksena; suojamekanismi, joka on vähemmän kehittynyt vertebrobasilar-järjestelmässä.18 Harvemmin harmaat aineet ja muut lohkot voivat vaikuttaa. Diffuusiosekvenssien sisältämät kuvat antavat mahdollisuuden erottaa PRES: lle tyypillinen vasogeeninen turvotus ja epätyypillisesti esiintyvä sytotoksinen ödeema, joka voi edetä infarktiksi.19 Elektroenkefalogrammi ei aina korreloi neurologisen vaikutuksen kanssa, mutta se voi paljastaa enkefalopatian terävien polttoväliaaltojen läsnäolo. Potilailla, joilla on kouristuksia, joihin liittyy PRES, tärkein elektroencefalografinen muutos on yleinen teeta / delta-taajuuksien hidastuminen.20 Aivo-selkäydinnesteen analyysi osoittaa epäspesifisiä muutoksia, kuten hiukkasen solukkuuden ja proteiinien lisääntymisen, ja siksi se on hyödyllinen, kun se on kätevä sulkemaan pois infektio keskushermostossa. 21 Edellä mainittujen testien lisäksi ne, joita pidetään välttämättöminä differentiaalidiagnoosin tekemiseksi, pääasiassa neurolupuksella, metabolisella ja parainfektion enkefalopatialla, enkefaliitilla, aivovaltimon takaosan infarktilla ja demyelinoivilla häiriöillä 22, 23 Edellä esitetyn perusteella kuvio 3 esittää Fugaten ym. ehdottaman algoritmin. PRES-diagnoosiin, jolla pyritään tunnistamaan epätyypillisetkin tapaukset.15
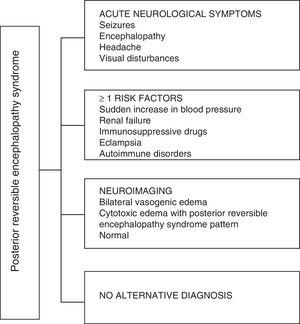
Diagnostinen algoritmi posterioriselle reversiibelille enkefalopatiaoireyhtymälle.
Potilaallamme PRES-diagnoosi oli kliinisen esityksen lisäksi useita riskitekijöitä, kuvantamistuloksia ja muiden etiologioiden poissulkemista. päätökseen. Oireinen hoito kouristuksia estävillä lääkkeillä ja aivojen vastaisella turvotuksella aloitettiin ajoissa yhdessä syy-tekijöiden hallinnan kanssa: vaikea hypertensio, vaikea-aktiivinen SLE, lupus glomerulonefriitti, immunosuppressiiviset lääkkeet; diagnoosin vahvistaminen seurannan aikana kliinisten ja kuvamuutosten korjaamisen avulla. PRES-hoidon osalta verenpainetta tulisi alentaa, kohtauksia hoitaa ja laukaisinta pitää hallita. Nopea verenpaineen lasku voi aiheuttaa aivojen iskemiaa, minkä vuoksi ehdotetaan tavoitetta keskimääräiselle verenpaineelle välillä 105 ja 125 mmHg, ylittämättä kuitenkaan 25% tästä alenemisesta ensimmäisen tunnin aikana. Ensimmäisen linjan lääkkeet ovat kalsiumkanavasalpaajat (nikardipiini tai nimodipiini, joka estää myös aivojen vasospasmin) tai beetasalpaajat (esimerkiksi labetaloli). Natriumnitroprussidia tai hydralatsiinia voidaan käyttää toisen linjan lääkkeinä. Nitroglyseriiniä tulisi välttää sen verisuonia laajentavan vaikutuksen vuoksi, mikä lisäisi aivojen turvotusta.24 Kohtausten hoito on samanlainen kuin muiden epileptisten kohtausten hoito. Bentsodiatsepiineja, kuten loratsepaamia tai diatsepaamia, käytetään ensilinjan hoitona. Toisena linjana fenytoiini tai valproaatti, erityisesti status epilepticus tai fenobarbitaali. Magnesiumsulfaattia voidaan käyttää raskaana oleville naisille. Tulenkestävissä kohtauksissa voimme antaa propofoli o pentobarbitaalia.25 Lääkkeitä, jotka voivat aiheuttaa lääkkeiden aiheuttamaa lupusta, kuten hydralatsiini, metyylidopa, kaptopriili, fenytoiini, valproaatti ja karbamatsepiini, tulisi välttää SLE-potilailla. Immunosuppressiivisten lääkkeiden hoidosta PRES-hoidossa on erimielisyyksiä SLE-potilailla. 26 PRES: n häviämisen jälkeen kohtaukset ovat harvinaisia, ja siksi on harkittava kouristuslääkkeiden lopettamista niin kauan kuin lääkkeiden hallintaa on riittävästi. riskitekijät.Oikeudenmukaisella ja riittävällä hoidolla suurin osa PRES-potilaista kehittyy tyydyttävästi oireiden remissioilla ja kuvahaavoilla muutamassa päivässä tai viikossa, vaikka 9–33 prosentissa tapauksista on havaittu komplikaatioita, erityisesti verenvuotoa aiheuttavia komplikaatioita. tapaus korostaa sen tunnistamisen ja hallinnan merkitystä, mikä on usein haaste.28
Päätelmät
PRES-diagnoosi vaatii suurta kliinistä ja kuvien epäilystä. Oikea-aikainen hoito oireiden ja taustalla olevan syyn hallitsemisella vahvistaa diagnoosin seurannan aikana kliinisten ja kuvamuutosten korjautuessa; muuten se voi aiheuttaa neurologisia seurauksia tai kuoleman.
Eturistiriita
Kirjoittajat ilmoittavat, ettei heillä ole eturistiriitoja.