Inledning
Posterior reversibel encefalopati syndrom (PRES) är en sällsynt komplikation från olika kliniska enheter. Dess förekomst är okänd, efter att ha rapporterats i ett stort antal åldrar från 14 till 78 år, med en genomsnittlig ålder på 44 år och ett förhållande mellan man och kvinna på 0,8 / 1,1 Även om prognosen vanligtvis är gynnsam, är dödligheten upp till 15 % har rapporterats.2 Det bestäms av typiska kliniska – radiologiska manifestationer, vanligtvis övergående.3 Antingen i akut eller subakut form, i fallande ordningsfrekvens uppträder det med encefalopati, anfall, huvudvärk, synstörningar och fokal neurologisk underskott.4 Flera patofysiologiska teorier har postulerats, varav två är de mest accepterade. Den första antyder att den plötsliga ökningen av blodtrycket överstiger självreglering av hjärnblodflödet, vilket orsakar vasodilatation och hyperperfusion med bristning av blod-hjärnbarriären (BBB) och vasogent ödem.5 Således har det klassiskt associerats med eklampsi och hypertensiv encefalopati; 20–30% av patienterna är dock normotensiva, vilket tyder på en andra teori om direkt endotel toxicitet orsakad av inflammatoriska mediatorer, mer korrelerad till patienter med immunsuppressiv behandling, njursvikt, bindvävssjukdomar eller sepsis.6 Det förekommer i 7 Magnetisk resonanstomografi ( MRI) i hjärnan är avgörande för diagnosen, vilket visar vasogent ödem, vanligtvis i det bakre hjärnområdet, bilateralt och symmetriskt.8 Eftersom diagnosen PRES kräver en hög klinisk och bildande misstankar, med efterföljande etablering av tidig behandling för en gynnsam prognos; syftet med detta arbete är att tillhandahålla information för erkännande och hantering av detta ovanliga syndrom associerat med SLE.
Beskrivning av fallet
En 25-årig mestizokvinna, från Quito, Ecuador, med personlig patologisk antecedenter av hypotyreos och SLE, diagnostiserade i december 2012, vid 21 års ålder. I december 2016, fyra år efter diagnosen SLE, presenterade hon en förvärring utlöst av akut diarrésjukdom. med muskuloskeletala (artrit, myalgi) och slemhinnor (orala sår), serosit (höger pleural effusion), bicytopeni (anemi, trombocytopeni), njurinvolvering (hematuri, proteinuri, akut njursvikt, klassificering av akut njurskada nätverk III) och arteriell hypertoni (AHT); som alla gav henne en hög SLEDAI (värde: 23). Njurbiopsin rapporterade fokal proliferativ lupus glomerulonefrit klass II, vilket inte motsvarade intensiv lupusaktivitet; utan förändringar hänförliga till antifosfolipidsyndrom, såväl som negativiteten hos dessa antikroppar. På grund av multiorganinvolveringen fick hon pulser av 1 g metylprednisolon intravenöst i 3 dagar, utbyte av blodprodukter, 6 sessioner med plasmaferes, hemodyalis, amlodipin 10 mg / dag, atenolol 50 mg / dag och mykofenolatmofetil 1 g / 12 timmar oralt, sedan hon presenterade gastrointestinal intolerans mot högre doser. Tre veckor efter inläggning presenterade hon acceptabel analytisk och klinisk förbättring med behandlingen, och därför var hennes ansvarsfrihet indikerad. Tjugofyra timmar senare kommer patienten tillbaka med en krampaktig status. I nödsituationer initierade de luftvägshantering, intravenösa antikonvulsiva medel med diazepam 10 mg, midazolam 3 mg, fenytoin 1 g och överförde henne till intensivvårdsavdelningen.
Det begärdes en kranial tomografi, som inte visade tecken på ischemi eller blödning. ; en högre occipital hypodensitet utan masseffekt observerades, och av denna anledning utvidgades provordningen till att identifiera dess etiologi. Metaboliska, infektiösa och farmakologiska orsaker uteslöts. På grund av svår kontrollerad AHT (upp till 190/100 mmHg med ett genomsnittligt arteriellt tryck på 130 mmHg) krävde patienten upp till 6 antihypertensiva läkemedel; atenolol 50 mg / 12 timmar, losartan 100 mg / dag, amlodipin 10 mg / dag, doxazosin 2 mg / 6 timmar via nasogastriskt rör och intravenös nitroprussid 50 mg / dag och furosemid 20 mg / 6 timmar. På grund av allvarlig lupusaktivitet (SLEDAI 21: anfall, hematuri, proteinuri, hypokomplementemi, anti-DNA, trombocytopeni) fick hon åter behandling med metylprednisolon 1 g / 3 dagar. Elektroencefalogrammet visade inte epileptiform aktivitet. Man begärde en cerebral angioresonans där fynd som var förenliga med vaskulit eller trombos i centrala nervsystemet inte hittades. MRI i hjärnan visade typiska bilder av PRES (Fig. 1), vars utveckling skulle vara relaterad till den förvärrade SLE, svår AHT, lupus glomerulonefrit och användning av immunsuppressiva medel, så oral nimodipin 60 mg / 6 timmar tillsattes och triggerfaktorerna kontrollerades .På grund av risken för läkemedelsinducerad lupus togs fenytoin gradvis ut, med progressiv ökning av levetiracetam upp till 1 g / 12 timmar via nasogastriskt rör. Tabell 1 beskriver relevanta kompletterande studier. Under uppföljningen presenterade hon inga nya krampanfall, njurfunktionen förblev still, blodtrycksvärdena förbättrades (MAP 85-90 mmHg) och lupusaktiviteten minskade (SLEDAI 13: hematuri, proteinuri, hypokomplementemi, anti-DNA , trombocytopeni). MRI i kontrollhjärnan visade involvering av de tidigare lesionerna (Fig. 2).
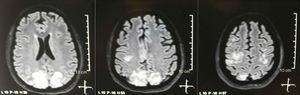
Enkel + diffusion av kärnmagnetisk resonansavbildning av hjärnan vid upptagande: bilaterala, symmetriska, hyperintensiva lesioner i FLAIR-sekvensen i vit substans av occipitala och parietala lober.
Relevanta kompletterande studier av ärendet.
| Datum | Kliniska tester |
|---|---|
| Förvärring av SLE 4 år efter diagnos | HB: hemoglobin 7 mg / dl; hematokrit 22,2%; blodplättar 75 000 / μlC-reaktivt protein: 2,52 mg / dl; prokalcitonin 0,348 ng / ml Kreatinin 5,7 mg / dl (eGFR CKD-EPI: 9,6 ml / min / 1,73 m2); urea 187 mg / dl Kreatinkinas: 18 U / l; laktatdehydrogenas: 237U / lMU: proteiner 150 mg / dl; röda blodkroppar 40,8 / fält; proteinuri: 1452 mg / 24 hC3: 36 mg / dl; C4: 15 mg / dl; anti-dsDNA: 200 IU / ml Lupus antikoagulant, antikardiolipiner, beta 2-glykoprotein 1: negativ Renal biopsi; focal lupus proliferativ glomerulonefrit klass II (ISN / RPS) med ett kroniskt och aktivitetsindex av 4 |
| Återupptagande | HB: hemoglobin 8,90 mg / dl; hematokrit 26,3%; trombocyter 130 000 / pl Kreatinin 2,77 mg / dl (eGFR CKD-EPI: 22,8 ml / min / 1,73 m2); urea 105,1 mg / dlLaktatdehydrogenas: 527U / 1; y-glutamyltransferas 79U / 1; alkaliskt fosfatas: 138U / 1; totalt bilirubin: 1,23 mg / dl; direkt: 0,50 mg / dl; indirekt: 0,73 mg / dlMU: proteiner 300 mg / dl; röda blodkroppar 44 / fält; proteinuria 1974mg / 24h Enkel kranial tomografi: höger occipital hypodensitet, utan masseffekt. Inga tecken på ischemi eller blödning Elektroencefalogram: bakgrunds hjärnaktivitet vid 4Hz i lågspännings theta-rytm. Närvaro av skarpa vassa vågor med bakre deltarytmer med interhemisfärisk symmetri, utan paroxysmal epileptiform aktivitetMagnetisk resonansangiografi av hjärnan i arteriella och venösa faser: utan vaskulära förändringar |
Anti-dsDNA: anti-dubbelsträngat DNA; HB: hematisk biometri; MU: mikroskopisk urinanalys; ISN / RPS: International Society of Nephrology / Renal Pathology Society; SLE: systemisk lupus erythematosus; eGFR CKD-EPI: glomerulär filtreringshastighet uppskattad med hjälp av ekvationen för Chronic Kidney Disease-Epidemiology Collaboration.
Diskussion
Sedan den första beskrivningen av PRES, gjord 1996 av Hinchey et al., har kunskapen om flera aspekter av denna enhet breddats. Dess ursprungliga namn på reversibelt bakre leukoencefalopatisyndrom resulterade i olämpligt, eftersom avbildningsförändringarna inte alltid är begränsade till hjärnvit substans och dess kliniska manifestationer inte alltid är reversibla.9 De första 15 rapporterade fallen inträffade hos patienter med hypertensiv encefalopati, eklampsi eller under immunsuppressiv behandling.10 Det har också observerats som en komplikation av andra enheter såsom sepsis, njursvikt och bindvävssjukdomar; därför är det för närvarande känt att riskfaktorerna som orsakar endotel dysfunktion är nyckeln för utvecklingen av PRES.11 Den globala incidensen är inte känd, men data från retrospektiva studier tyder på att det är vanligare hos individer mellan 39 och 47 år, generellt kvinnor med komorbiditeter såsom hypertensiva, njursjuka eller autoimmuna sjukdomar.12 Hos patienter med SLE riktas många autoantikroppar mot endotel; producerar dess aktivering, uttryck av vidhäftningsmolekyler (E-selectin, VCAM-1, ICAM-1) och exponering för proinflammatoriska cytokiner såsom IL-1β, TNFa och IL-6, vilket orsakar störning av BBB och uppkomst av neurologiska komplikationer.13 Det har rapporterats att hos personer som diagnostiserats med SLE uppträder PRES i samband med måttlig till svår lupusaktivitet, liksom i samband med njursvikt och dåligt kontrollerad hypertoni.14
När det gäller PRES kliniska manifestationer kännetecknas det av varierande grader av encefalopati, från förvirring till dumhet (50-80%), anfall (60-75%), huvudvärk (50%) och synstörningar som sträcker sig från suddig syn till kortikal blindhet (33%); som är ovanligt är det fokala neurologiska underskottet (10–15%) och statusen epileptiker (5–15%). 15 För den första bedömningen av den neurologiska kompromissen hos dessa patienter, begärs vanligen en skanbar datortaxografi (CT), som är ofta normalt eller kan uppvisa kortikal – subkortisk hypodensitet, främst i bakre hjärnregioner.16 Hjärnans MR bestämmer diagnosen och visar vasogent ödem, vanligtvis i den vita substansen i occipitala och parietala lober (territorium av den bakre hjärncirkulationen) , visualiseras som hyperintense lesioner i T2 och FLAIR, bilaterala och symmetriska.17 Det föredragna engagemanget för den vita substansen beror på dess struktur av myeliniserade fibrer, arterioler och kapillärer som ger det större slapphet. På samma sätt kan kärlen i den främre hjärncirkulationen, med större sympatisk innervering, adekvat svara genom vasokonstriktion på den plötsliga ökningen av hjärnblodflödet sekundärt till högt blodtryck; en skyddsmekanism som är mindre utvecklad i det vertebrobasilar systemet.18 Mindre ofta kan grå substans och andra lober påverkas. Bilderna med diffusionssekvenser gör det möjligt att skilja mellan det vasogena ödemet, typiskt för PRES, och det cytotoxiska ödemet som kan förekomma atypiskt och kan utvecklas till infarkt.19 Elektroencefalogrammet korrelerar inte alltid med den neurologiska påverkan, men det kan avslöja encefalopati genom närvaron av fokala vassa vågor. Hos patienter med anfall associerade med PRES är den huvudsakliga elektroencefalografiska förändringen den allmänna avmattningen i theta / delta-frekvenser.20 Analysen av cerebrospinalvätskan visar icke-specifika förändringar såsom en liten ökning av celluläritet och proteiner, och därför är det användbart när det är bekvämt att utesluta en infektion i centrala nervsystemet.21 Förutom de ovan nämnda testerna, de som anses nödvändiga för differentiell diagnos, främst med neurolupus, metabolisk och parainfektiös encefalopati, encefalit, infarkt i den bakre hjärnartären och demyeliniserande störningar måste utföras. 22,23 Baserat på det föregående visar fig. 3 algoritmen föreslagen av Fugate et al. för diagnos av PRES, som syftar till att identifiera även atypiska fall.15
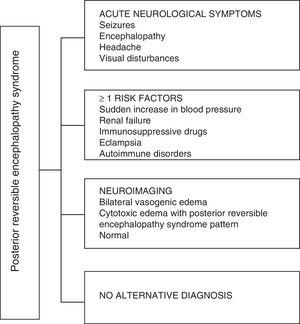
Diagnostisk algoritm för bakre reversibelt encefalopatisyndrom.
Hos vår patient, med tanke på den kliniska presentationen tillsammans med flera riskfaktorer, avbildningsresultat och uteslutning av andra etiologier, var diagnosen PRES avslutade. Symptomatisk behandling med antikonvulsiva läkemedel och anti-cerebralt ödem inleddes i rätt tid, tillsammans med kontrollen av de orsakande faktorerna: svår hypertoni, SLE med svår aktivitet, lupus glomerulonefrit, immunsuppressiva läkemedel; ratificera diagnosen under uppföljningen med upplösning av de kliniska och bildförändringarna. När det gäller hanteringen av PRES bör blodtrycket sänkas, krampanfallen behandlas och avtryckaren kontrolleras. Den snabba blodtryckssänkningen kan orsaka cerebral ischemi, varför ett mål om ett genomsnittligt blodtryck mellan 105 och 125 mmHg föreslås, utan att överstiga 25% av denna minskning under den första timmen. De första raden av läkemedel är kalciumkanalblockerare (nikardipin eller nimodipin som valts, vilket också förhindrar cerebral vasospasm) eller betablockerare (till exempel labetalol). Natriumnitroprussid eller hydralazin kan användas som andra linjens läkemedel. Nitroglycerin bör undvikas på grund av dess vasodilaterande effekt, vilket skulle öka hjärnödemet.24 Behandlingen av kramperna liknar den för andra epileptiska krampanfall. Bensodiazepiner som lorazepam eller diazepam används som förstahandsbehandling. Som andra linje, fenytoin eller valproat, särskilt i status epilepticus, eller fenobarbital. Magnesiumsulfat kan användas hos gravida kvinnor. Vid eldfasta anfall kan vi ge propofol o pentobarbital.25 Läkemedel som kan orsaka läkemedelsinducerad lupus, såsom hydralazin, metyldopa, kaptopril, fenytoin, valproat och karbamazepin, bör undvikas hos patienter med SLE. Det finns kontroverser om hanteringen av immunsuppressiva läkemedel vid behandling av PRES hos patienter med SLE.26 Efter upplösningen av PRES är anfall sällsynta, och därför bör det övervägas att avbryta antikonvulsiva medel så länge det finns en adekvat kontroll av riskfaktorerna.27 Med en snabb och adekvat behandling utvecklas majoriteten av patienter med PRES tillfredsställande med remission av symtomen och bildskador på några dagar eller veckor, även om komplikationer, speciellt blödande, har observerats i 9–33% av fallen, så detta fall lyfter fram vikten av dess erkännande och hantering, vilket ofta är en utmaning.28
Slutsatser
Diagnosen PRES kräver en hög klinisk misstanke och avbildning. Tidig behandling med kontroll av symtomen och den bakomliggande orsaken ratificerar diagnosen under uppföljningen, med upplösning av kliniska och bildförändringar; annars kan det orsaka neurologiska följder eller död.
Intressekonflikt
Författarna förklarar att de inte har någon intressekonflikt.