Introdução
A síndrome da encefalopatia reversível posterior (PRES) é uma complicação rara de várias entidades clínicas. Sua incidência é desconhecida, tendo sido relatada em uma ampla faixa de idades de 14 a 78 anos, com média de idade de 44 anos e razão homem / mulher de 0,8 / 1,1. Embora o prognóstico seja geralmente favorável, taxas de mortalidade de até 15 % foram relatados.2 É determinado por manifestações clínico-radiológicas típicas, geralmente transitórias.3 Na forma aguda ou subaguda, em ordem decrescente de frequência, ocorre com encefalopatia, convulsões, cefaleia, distúrbios visuais e déficit neurológico focal.4 Várias teorias fisiopatológicas foram postuladas, sendo duas as mais aceitas. A primeira sugere que o aumento repentino da pressão arterial excede a autorregulação do fluxo sanguíneo cerebral, causando vasodilatação e hiperperfusão, com ruptura da barreira hematoencefálica (BHE) e edema vasogênico.5 Assim, tem sido classicamente associado a eclâmpsia e encefalopatia hipertensiva; no entanto, 20-30% dos pacientes são normotensos, sugerindo uma segunda teoria de toxicidade endotelial direta causada por mediadores inflamatórios, mais correlacionada a pacientes com tratamento imunossupressor, insuficiência renal, distúrbios do tecido conjuntivo ou sepse.6 Ocorre em 7 Ressonância magnética ( RM) do cérebro é determinante para o diagnóstico, evidenciando edema vasogênico, geralmente em território cerebral posterior, bilateral e simétrico.8 Já o diagnóstico de PRES requer alta suspeita clínica e de imagem, com posterior estabelecimento de tratamento precoce para um quadro favorável prognóstico; o objetivo deste trabalho é fornecer informações para o reconhecimento e manejo desta síndrome incomum associada ao LES.
Descrição do caso
Mulher, 25 anos, mestiça, de Quito, Equador, com patologia pessoal antecedentes de hipotireoidismo e LES, diagnosticados em dezembro de 2012, aos 21 anos. Em dezembro de 2016, 4 anos após o diagnóstico de LES, apresentou uma exacerbação desencadeada por doença diarreica aguda; com manifestações musculoesqueléticas (artrite, mialgias) e mucocutâneas (úlceras orais), serosite (derrame pleural direito), bicitopenia (anemia, trombocitopenia), envolvimento renal (hematúria, proteinúria, insuficiência renal aguda, classificação da Rede de Lesões Renais Agudas III) e hipertensão arterial (AHT); tudo isso conferido a ela um alto SLEDAI (valor: 23). A biópsia renal relatou glomerulonefrite lúpica proliferativa focal classe II, não correspondendo a intensa atividade lúpica; sem alterações atribuíveis à síndrome antifosfolípide, bem como a negatividade desses anticorpos. Devido ao envolvimento de múltiplos órgãos, recebeu pulsos de 1g de metilprednisolona intravenosa por 3 dias, reposição de hemoderivados, 6 sessões de plasmaférese, hemodiálise, amlodipina 10mg / dia, atenolol 50mg / dia e micofenolato mofetil 1g / 12h por via oral, desde ela apresentou intolerância gastrointestinal a doses maiores. Três semanas após a admissão, apresentou melhora analítica e clínica aceitável com o tratamento, sendo indicada a alta hospitalar. Vinte e quatro horas depois, o paciente volta a entrar em estado convulsivo. Nas emergências iniciaram o manejo das vias aéreas, anticonvulsivantes intravenosos com diazepam 10mg, midazolam 3mg, fenitoína 1g e a transferiram para unidade de terapia intensiva.
Foi solicitada tomografia craniana, que não mostrou sinais de isquemia ou sangramento ; observou-se hipodensidade occipital direita sem efeito de massa, motivo pelo qual a ordem dos exames foi ampliada para identificação de sua etiologia. Foram excluídas causas metabólicas, infecciosas e farmacológicas. Devido ao AHT de difícil controle (até 190 / 100mmHg com pressão arterial média de 130mmHg), o paciente necessitou de até 6 anti-hipertensivos; atenolol 50mg / 12h, losartana 100mg / dia, amlodipina 10mg / dia, doxazosina 2mg / 6h via sonda nasogástrica e nitroprussiato intravenoso 50mg / dia e furosemida 20mg / 6h. Devido à intensa atividade lúpica (SLEDAI 21: convulsões, hematúria, proteinúria, hipocomplementemia, anti-DNA, trombocitopenia), voltou a receber tratamento com metilprednisolona 1g / 3 dias. O eletroencefalograma não mostrou atividade epileptiforme. Foi solicitada angiorressonância cerebral na qual não foram encontrados achados compatíveis com vasculite ou trombose do sistema nervoso central. A ressonância magnética do cérebro evidenciou imagens típicas de PRES (fig. 1), cujo desenvolvimento estaria relacionado ao LES exacerbado, HTA grave, glomerulonefrite lúpica e uso de imunossupressores, portanto, foi adicionada nimodipina oral 60mg / 6h e os fatores desencadeadores controlados .Devido ao risco de lúpus induzido por medicamentos, a fenitoína foi suspensa gradativamente, com aumento progressivo do levetiracetam até 1g / 12h por sonda nasogástrica. A Tabela 1 detalha os estudos complementares relevantes. Durante o acompanhamento, ela não apresentou novos eventos convulsivos, a função renal permaneceu estacionária, os valores da pressão arterial melhoraram (MAP 85-90 mmHg) e a atividade lúpica diminuiu (SLEDAI 13: hematúria, proteinúria, hipocomplementemia, anti-DNA , trombocitopenia). A ressonância magnética do cérebro de controle evidenciou involução das lesões anteriores (Fig. 2).
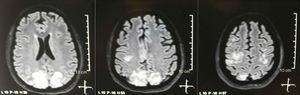
Imagem de ressonância magnética nuclear simples + difusão do cérebro na admissão: lesões bilaterais, simétricas e hiperintensas na sequência FLAIR na substância branca dos lobos occipital e parietal.
Estudos complementares relevantes do caso.
| Data | Testes clínicos |
|---|---|
| Exacerbação de SLE 4 anos após o diagnóstico | HB: hemoglobina 7mg / dl; hematócrito 22,2%; plaquetas 75.000 / proteína reativa μlC: 2,52mg / dl; procalcitonina 0,348 ng / mlCreatinina 5,7 mg / dl (eGFR CKD-EPI: 9,6 ml / min / 1,73m2); ureia 187 mg / dlCreatina quinase: 18 U / l; lactato desidrogenase: 237U / lMU: proteínas 150 mg / dl; glóbulos vermelhos 40,8 / campo; proteinúria: 1452mg / 24hC3: 36mg / dl; C4: 15mg / dl; anti-dsDNA: 200 UI / ml anticoagulante Lupus, anticardiolipinas, beta 2-glicoproteína 1: negativoBiópsia renal; glomerulonefrite proliferativa lúpica focal de classe II (ISN / RPS) com cronicidade e índice de atividade de 4 |
| Readmissão | HB: hemoglobina 8,90 mg / dl; hematócrito 26,3%; plaquetas 130.000 / μlCreatinina 2,77mg / dl (eGFR CKD-EPI: 22,8ml / min / 1,73m2); ureia 105,1 mg / dlLactato desidrogenase: 527U / l; y-glutamil transferase 79U / l; fosfatase alcalina: 138U / l; bilirrubina total: 1,23mg / dl; direto: 0,50mg / dl; indireto: 0,73mg / dlMU: proteínas 300mg / dl; glóbulos vermelhos 44 / campo; proteinúria 1974mg / 24hTomografia craniana simples: hipodensidade occipital direita, sem efeito de massa. Sem sinais de isquemia ou sangramento. Eletroencefalograma: atividade cerebral de fundo a 4 Hz em ritmo teta de baixa voltagem. Presença de ondas agudas de vértice com ritmos delta posterior com simetria inter-hemisférica, sem atividade epileptiforme paroxística Angiografia por ressonância magnética do cérebro nas fases arterial e venosa: sem alterações vasculares |
Anti-dsDNA: anti-DNA de fita dupla; HB: biometria hemática; MU: urinálise microscópica; ISN / RPS: Sociedade Internacional de Nefrologia / Sociedade de Patologia Renal; LES: lúpus eritematoso sistêmico; eGFR CKD-EPI: taxa de filtração glomerular estimada usando a equação da Colaboração Chronic Kidney Disease-Epidemiology.
Discussão
Desde a primeira descrição do PRES, feita em 1996 por Hinchey et al., o conhecimento de vários aspectos desta entidade foi ampliado. Seu nome original de síndrome de leucoencefalopatia posterior reversível resultou inadequado, uma vez que as alterações de imagem nem sempre se limitam à substância branca cerebral e suas manifestações clínicas nem sempre são reversíveis.9 Os primeiros 15 casos relatados ocorreram em pacientes com encefalopatia hipertensiva, eclâmpsia ou sob imunossupressor tratamento.10 Também tem sido observada como complicação de outras entidades, como sepse, insuficiência renal e distúrbios do tecido conjuntivo; portanto, sabe-se atualmente que os fatores de risco que causam disfunção endotelial são fundamentais para o desenvolvimento da PRES.11 A incidência global não é conhecida, mas dados de estudos retrospectivos indicam que é mais frequente em indivíduos entre 39 e 47 anos, geralmente mulheres, com comorbidades como distúrbios hipertensivos, renais ou autoimunes.12 Em pacientes com LES, muitos autoanticorpos são direcionados contra o endotélio; produzindo sua ativação, expressão de moléculas de adesão (E-selectina, VCAM-1, ICAM-1) e exposição a citocinas pró-inflamatórias como IL-1β, TNFα e IL-6, causando ruptura da BBB e aparecimento de complicações neurológicas.13 Foi relatado que, em pessoas com diagnóstico de LES, a PRES ocorre no contexto de atividade lúpica moderada a grave, bem como associada a insuficiência renal e hipertensão mal controlada.14
Em relação às manifestações clínicas da PRES, é caracterizada por graus variáveis de encefalopatia, de confusão a estupor (50-80%), convulsões (60-75%), cefaleia (50%) e distúrbios visuais que variam de visão turva a cegueira cortical (33%); sendo incomum o déficit neurológico focal (10-15%) e o estado de epilepsia (5-15%). 15 Para a avaliação inicial do comprometimento neurológico nesses pacientes, uma tomografia axial computadorizada (TC) de crânio é geralmente solicitada, a qual frequentemente é normal ou pode mostrar hipodensidades cortico-subcorticais, predominantemente nas regiões cerebrais posteriores.16 A ressonância magnética do cérebro determina o diagnóstico, mostrando edema vasogênico, geralmente na substância branca dos lobos occipital e parietal (território da circulação cerebral posterior) , visualizadas como lesões hiperintensas em T2 e FLAIR, bilaterais e simétricas.17 O acometimento preferencial da substância branca se deve à sua estrutura de fibras mielinizadas, arteríolas e capilares que lhe conferem maior frouxidão. Da mesma forma, os vasos da circulação cerebral anterior, tendo maior inervação simpática, podem responder adequadamente por vasoconstrição ao aumento repentino do fluxo sanguíneo cerebral secundário à hipertensão; um mecanismo de proteção menos desenvolvido no sistema vertebrobasilar.18 Com menos frequência, a substância cinzenta e outros lobos podem ser afetados. As imagens com sequências de difusão permitem distinguir entre o edema vasogênico, típico da PRES, e o edema citotóxico que pode ocorrer atipicamente e pode evoluir para infarto.19 O eletroencefalograma nem sempre se correlaciona com a afetação neurológica, mas pode revelar encefalopatia por a presença de ondas agudas focais. Em pacientes com convulsões associadas à PRES, a principal alteração eletroencefalográfica é a desaceleração geral nas frequências teta / delta.20 A análise do líquido cefalorraquidiano mostra alterações inespecíficas, como um ligeiro aumento da celularidade e proteínas, e, portanto, é útil quando é conveniente para descartar infecção do sistema nervoso central.21 Além dos exames citados, os que são considerados necessários para o diagnóstico diferencial, principalmente com neurolúpus, encefalopatia metabólica e parainfecciosa, encefalite, infarto da artéria cerebral posterior e doenças desmielinizantes deve ser executado.22,23 Com base no exposto, a Fig. 3 mostra o algoritmo proposto por Fugate et al. para o diagnóstico de PRES, que visa identificar até mesmo casos atípicos.15
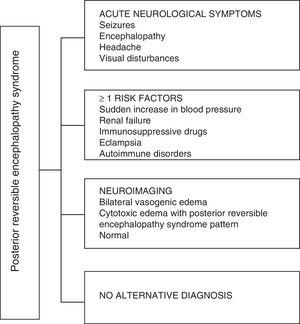
Algoritmo de diagnóstico para síndrome de encefalopatia reversível posterior.
Em nosso paciente, dada a apresentação clínica, juntamente com os múltiplos fatores de risco, achados de imagem e exclusão de outras etiologias, o diagnóstico de PRES foi concluído. O tratamento sintomático com medicação anticonvulsivante e edema anticerebral foi instituído em tempo hábil, juntamente com o controle dos fatores causais: hipertensão grave, LES com atividade grave, lúpus glomerulonefrite, imunossupressores; ratificar o diagnóstico durante o seguimento com resolução das alterações clínicas e de imagem. No que diz respeito ao manejo do PRES, a pressão arterial deve ser reduzida, as convulsões devem ser tratadas e o gatilho deve ser controlado. A queda rápida da pressão arterial pode causar isquemia cerebral, razão pela qual se sugere uma meta de pressão arterial média entre 105 e 125mmHg, sem ultrapassar 25% dessa redução na primeira hora. Os medicamentos de primeira linha são bloqueadores dos canais de cálcio (nicardipina ou nimodipina de escolha, que também previne o vasoespasmo cerebral) ou beta-bloqueadores (por exemplo, labetalol). Nitroprussiato de sódio ou hidralazina podem ser usados como medicamentos de segunda linha. A nitroglicerina deve ser evitada devido ao seu efeito vasodilatador, que aumentaria o edema cerebral.24 O tratamento das crises é semelhante ao de outras crises epilépticas. Benzodiazepínicos como lorazepam ou diazepam são usados como terapia de primeira linha. Como segunda linha, fenitoína ou valproato, especialmente no estado de mal epiléptico ou fenobarbital. O sulfato de magnésio pode ser usado em mulheres grávidas. Nas convulsões refratárias, podemos administrar propofol ou pentobarbital.25 Drogas que podem causar lúpus induzido por drogas, como hidralazina, metildopa, captopril, fenitoína, valproato e carbamazepina, devem ser evitadas em pacientes com LES. Há controvérsias sobre o manejo de medicamentos imunossupressores no tratamento da PRES em pacientes com LES.26 Após a resolução da PRES, as crises são infrequentes e, portanto, deve-se considerar a suspensão dos anticonvulsivantes desde que haja controle adequado da os fatores de risco.27 Com tratamento oportuno e adequado, a maioria dos pacientes com PRES evolui satisfatoriamente com remissão dos sintomas e lesões de imagem em poucos dias ou semanas, embora complicações, principalmente hemorrágicas, tenham sido observadas em 9–33% dos casos, portanto este O caso destaca a importância de seu reconhecimento e manejo, o que muitas vezes é um desafio.28
Conclusões
O diagnóstico de PRES requer alta suspeita clínica e por imagem. O tratamento oportuno com controle dos sintomas e da causa básica ratifica o diagnóstico durante o seguimento, com resolução das alterações clínicas e de imagem; caso contrário, pode causar sequelas neurológicas ou morte.
Conflito de interesses
Os autores declaram não haver conflito de interesses.