Introduktion
Posterior reversibel encefalopati syndrom (PRES) er en sjælden komplikation fra forskellige kliniske enheder. Dens forekomst er ukendt, der er rapporteret i en bred vifte af aldre fra 14 til 78 år med en gennemsnitsalder på 44 år og et forhold mellem mand og kvinde på 0,8 / 1,1 Selv om prognosen normalt er gunstig, er dødeligheden på op til 15 % er rapporteret.2 Det bestemmes af typiske kliniske – radiologiske manifestationer, normalt forbigående.3 Enten i akut eller subakut form, i faldende rækkefølge efter hyppighed, forekommer det med encefalopati, kramper, hovedpine, synsforstyrrelser og fokal neurologisk underskud.4 Flere patofysiologiske teorier er blevet postuleret, hvoraf to er de mest accepterede. Den første antyder, at den pludselige stigning i blodtrykket overstiger selvreguleringen af cerebral blodgennemstrømning, der forårsager vasodilatation og hyperperfusion med brud på blod-hjerne-barrieren (BBB) og vasogent ødem.5 Det har således været klassisk forbundet med eclampsia og hypertensiv encefalopati; 20-30% af patienterne er dog normotensive, hvilket tyder på en anden teori om direkte endotel-toksicitet forårsaget af inflammatoriske mediatorer, mere korreleret med patienter med immunsuppressiv behandling, nyresvigt, bindevævssygdomme eller sepsis.6 Det forekommer i 7 Magnetisk resonansbilleddannelse ( MR) i hjernen er afgørende for diagnosen og viser vasogent ødem, sædvanligvis i det bageste cerebrale område, bilateralt og symmetrisk.8 Da diagnosen af PRES kræver en høj klinisk og billeddannende mistanke, med den efterfølgende etablering af tidlig behandling for en gunstig prognose; Målet med dette arbejde er at give information til anerkendelse og styring af dette usædvanlige syndrom forbundet med SLE.
Beskrivelse af sagen
En 25-årig mestizo-kvinde fra Quito, Ecuador, med personlig patologisk antecedenter for hypothyroidisme og SLE, diagnosticeret i december 2012, i en alder af 21 år. I december 2016, 4 år efter diagnosen SLE, præsenterede hun en forværring udløst af akut diarrésygdom; med muskuloskeletale (arthritis, myalgi) og slimhinde (orale sår) manifestationer, serositis (højre pleural effusion), bicytopeni (anæmi, trombocytopeni), nyreinddragelse (hæmaturi, proteinuri, akut nyresvigt, akut nyreskadeklassifikation III) og arteriel hypertension (AHT); som alle tildelte hende en høj SLEDAI (værdi: 23). Renalbiopsien rapporterede fokal proliferativ lupus glomerulonephritis klasse II, der ikke svarede til intens lupusaktivitet; uden ændringer, der kan tilskrives antiphospholipidsyndrom, såvel som negativiteten af disse antistoffer. På grund af multi-organ involveringen modtog hun pulser af 1 g methylprednisolon intravenøst i 3 dage, udskiftning af blodprodukter, 6 sessioner med plasmaferese, hæmodyalisis, amlodipin 10 mg / dag, atenolol 50 mg / dag og mycophenolatmofetil 1 g / 12 timer oralt, siden hun præsenterede gastrointestinal intolerance over for højere doser. Tre uger efter indlæggelse præsenterede hun acceptabel analytisk og klinisk forbedring med behandlingen, og derfor blev hendes hospitalsudskrivelse indikeret. Fireogtyve timer senere kommer patienten tilbage med en krampestatus. I nødsituationer indledte de luftvejsstyring, intravenøse antikonvulsiva med diazepam 10 mg, midazolam 3 mg, phenytoin 1 g og overførte hende til intensivafdelingen.
Det blev anmodet om en kranietomografi, som ikke viste tegn på iskæmi eller blødning. ; en højre occipital hypodensitet uden masseeffekt blev observeret, og af denne grund blev rækkefølgen af eksamener udvidet til at identificere dens etiologi. Metaboliske, infektiøse og farmakologiske årsager blev udelukket. På grund af AHT, der er vanskelig at kontrollere (op til 190/100 mmHg med et gennemsnitligt arterielt tryk på 130 mmHg), krævede patienten op til 6 antihypertensive lægemidler; atenolol 50 mg / 12 timer, losartan 100 mg / dag, amlodipin 10 mg / dag, doxazosin 2 mg / 6 timer via nasogastrisk rør og intravenøs nitroprussid 50 mg / dag og furosemid 20 mg / 6 timer. På grund af svær lupusaktivitet (SLEDAI 21: krampeanfald, hæmaturi, proteinuri, hypokomplementæmi, anti-DNA, trombocytopeni), fik hun igen behandling med methylprednisolon 1 g / 3 dage. Elektroencefalogrammet udviste ikke epileptiform aktivitet. Det blev anmodet om en cerebral angioresonans, hvor fund, der var i overensstemmelse med vaskulitis eller trombose i centralnervesystemet, ikke blev fundet. MR i hjernen viste typiske billeder af PRES (fig. 1), hvis udvikling ville være relateret til den forværrede SLE, svær AHT, lupus glomerulonephritis og brug af immunsuppressiva, så oral nimodipin 60 mg / 6 timer blev tilsat, og triggerfaktorerne blev kontrolleret .På grund af risikoen for medikamentinduceret lupus blev phenytoin gradvist trukket tilbage med progressiv stigning af levetiracetam op til 1 g / 12 timer via nasogastrisk rør. Tabel 1 beskriver de relevante supplerende undersøgelser. Under opfølgningen præsenterede hun ikke nye krampeanfald, nyrefunktionen forblev stationær, blodtryksværdierne forbedret (MAP 85-90mmHg), og lupusaktiviteten faldt (SLEDAI 13: hæmaturi, proteinuri, hypokomplementæmi, anti-DNA , trombocytopeni). MR i kontrolhjernen viste bevidsthed om de tidligere læsioner (fig. 2).
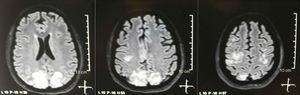
Enkel + diffusion kernemagnetisk resonansbilleddannelse af hjernen ved optagelse: bilaterale, symmetriske, hyperintense læsioner i FLAIR-sekvens i hvidt stof af occipital og parietal lapper.
Relevante supplerende undersøgelser af sagen.
| Dato | Kliniske tests |
|---|---|
| Forværring af SLE 4 år efter diagnose | HB: hæmoglobin 7 mg / dl; hæmatokrit 22,2%; blodplader 75.000 / μlC-reaktivt protein: 2,52 mg / dl; procalcitonin 0,348 ng / ml Kreatinin 5,7 mg / dl (eGFR CKD-EPI: 9,6 ml / min / 1,73 m2); urinstof 187 mg / dl Kreatinkinase: 18 U / l; lactatdehydrogenase: 237U / lMU: proteiner 150 mg / dl; røde blodlegemer 40,8 / felt; proteinuria: 1452 mg / 24 hC3: 36 mg / dl; C4: 15 mg / dl; anti-dsDNA: 200 IU / ml Lupus antikoagulant, anticardiolipiner, beta 2-glycoprotein 1: negativ Renal biopsi; focal lupus proliferativ glomerulonephritis klasse II (ISN / RPS) med et kronisk og aktivitetsindeks på 4 |
| Genoptagelse |
Anti-dsDNA: anti-dobbeltstrenget DNA; HB: hæmatisk biometri; MU: mikroskopisk urinalyse; ISN / RPS: International Society of Nephrology / Renal Pathology Society; SLE: systemisk lupus erythematosus; eGFR CKD-EPI: glomerulær filtreringshastighed estimeret ved hjælp af ligningen af det kroniske nyresygdom-epidemiologisk samarbejde.
Diskussion
Siden den første beskrivelse af PRES, lavet i 1996 af Hinchey et al., er viden om flere aspekter af denne enhed blevet udvidet. Dets oprindelige navn for reversibelt posteriort leukoencefalopatisyndrom resulterede uhensigtsmæssigt, da billeddannelsesændringerne ikke altid er begrænset til den cerebrale hvide substans, og dens kliniske manifestationer ikke altid er reversible.9 De første 15 rapporterede tilfælde forekom hos patienter med hypertensiv encefalopati, eclampsia eller under immunsuppressiv behandling.10 Det er også blevet observeret som en komplikation af andre enheder såsom sepsis, nyresvigt og bindevævssygdomme; derfor er det i øjeblikket kendt, at de risikofaktorer, der forårsager endotel dysfunktion, er nøglen til udviklingen af PRES.11 Den globale forekomst er ikke kendt, men data fra retrospektive undersøgelser indikerer, at det er hyppigere hos personer mellem 39 og 47 år, generelt kvinder med comorbiditeter såsom hypertensive, nyre- eller autoimmune lidelser.12 Hos patienter med SLE er mange autoantistoffer rettet mod endotelet; producerer dets aktivering, ekspression af adhæsionsmolekyler (E-selectin, VCAM-1, ICAM-1) og eksponering for proinflammatoriske cytokiner såsom IL-1β, TNFa og IL-6, hvilket forårsager forstyrrelse af BBB og fremkomst af neurologiske komplikationer.13 Det er blevet rapporteret, at hos mennesker diagnosticeret med SLE forekommer PRES i sammenhæng med moderat til svær lupusaktivitet såvel som forbundet med nyresvigt og dårligt kontrolleret hypertension.14
Med hensyn til de kliniske manifestationer af PRES er det kendetegnet ved variable grader af encefalopati, fra forvirring til bedøvelse (50-80%), anfald (60-75%), hovedpine (50%) og synsforstyrrelser lige fra sløret syn til kortikal blindhed (33%) er usædvanligt det fokale neurologiske underskud (10–15%) og status epileptisk (5–15%). 15 Til den indledende vurdering af det neurologiske kompromis hos disse patienter, kræves der normalt en CT-scanning (cranial computed axial tomography), som er ofte normal eller kan vise kortikal – subkortisk hypodensitet, overvejende i bageste hjerneområder.16 MR-en i hjernen bestemmer diagnosen, der viser vasogent ødem, normalt i det hvide stof i occipitale og parietale lapper (område af den bageste cerebrale cirkulation) , visualiseret som hyperintense læsioner i T2 og FLAIR, bilaterale og symmetriske.17 Den foretrukne involvering af det hvide stof skyldes dets struktur af myeliniserede fibre, arterioler og kapillærer, som giver det større sløvhed. Tilsvarende kan karene i den forreste cerebrale cirkulation, der har større sympatisk innervation, tilstrækkeligt reagere ved vasokonstriktion på den pludselige stigning i cerebral blodgennemstrømning sekundært til hypertension; en beskyttelsesmekanisme, der er mindre udviklet i det vertebrobasilar system.18 Oftere kan grå substans og andre lapper blive påvirket. Billederne med diffusionssekvenser gør det muligt at skelne mellem det vasogene ødem, der er typisk for PRES, og det cytotoksiske ødem, der kan forekomme atypisk og kan udvikle sig til infarkt.19 Elektroencefalogrammet korrelerer ikke altid med den neurologiske påvirkning, men det kan afsløre encefalopati ved tilstedeværelsen af fokale skarpe bølger. Hos patienter med krampeanfald associeret med PRES er den vigtigste elektroencefalografiske ændring den generelle opbremsning i theta / delta-frekvenser.20 Analysen af cerebrospinalvæsken viser uspecifikke ændringer såsom en let stigning i cellularitet og proteiner, og derfor er det nyttigt, når det er bekvemt at udelukke en infektion i centralnervesystemet.21 Ud over de ovennævnte tests er de, der anses for nødvendige for den differentielle diagnose, hovedsageligt med neurolupus, metabolisk og parainfektiøs encefalopati, encefalitis, infarkt i den bageste cerebrale arterie og demyeliniserende lidelser skal udføres. 22,23 Baseret på det foregående viser fig. 3 algoritmen foreslået af Fugate et al. til diagnosticering af PRES, som har til formål at identificere selv atypiske tilfælde.15
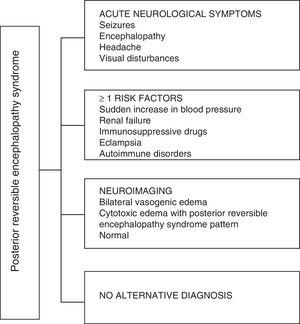
Diagnostisk algoritme for posterior reversibel encefalopatisyndrom.
På grund af den kliniske præsentation sammen med de mange risikofaktorer, billeddannelsesresultater og udelukkelse af andre etiologier, var diagnosen PRES konkluderede. Symptomatisk behandling med antikonvulsiv medicin og anti-cerebralt ødem blev iværksat i tide sammen med kontrol af de forårsagende faktorer: svær hypertension, SLE med svær aktivitet, lupus glomerulonephritis, immunsuppressive lægemidler; ratificering af diagnosen under opfølgningen med opløsning af de kliniske og billeddannende ændringer. Med hensyn til håndteringen af PRES bør blodtrykket sænkes, krampeanfaldene behandles og udløseren kontrolleres. Det hurtige fald i blodtrykket kan forårsage cerebral iskæmi, hvorfor et mål om et gennemsnitligt blodtryk mellem 105 og 125 mmHg foreslås uden at overstige 25% af denne reduktion i den første time. Førstelinjemedicinerne er calciumkanalblokkere (nicardipin eller nimodipin efter eget valg, der også forhindrer cerebral vasospasme) eller betablokkere (for eksempel labetalol). Natriumnitroprussid eller hydralazin kan anvendes som andenlinielægemidler. Nitroglycerin bør undgås på grund af dets vasodilaterende virkning, hvilket vil øge cerebralt ødem.24 Behandlingen af krampeanfald svarer til den for andre epileptiske anfald. Benzodiazepiner såsom lorazepam eller diazepam anvendes som førstelinjeterapi. Som anden linje, phenytoin eller valproat, især i status epilepticus eller phenobarbital. Magnesiumsulfat kan anvendes til gravide kvinder. I ildfaste anfald kan vi give propofol o pentobarbital.25 Lægemidler, der kan forårsage lægemiddelinduceret lupus, såsom hydralazin, methyldopa, captopril, phenytoin, valproat og carbamazepin, bør undgås hos patienter med SLE. Der er kontroverser omkring håndtering af immunsuppressive lægemidler ved behandling af PRES hos patienter med SLE.26 Efter opløsningen af PRES er anfald sjældne, og det bør derfor overvejes at afbryde antikonvulsiva, så længe der er tilstrækkelig kontrol med risikofaktorerne.27 Med en rettidig og tilstrækkelig behandling udvikler flertallet af patienter med PRES tilfredsstillende med remission af symptomerne og billeddannelseslæsioner i løbet af få dage eller uger, selvom komplikationer, specielt blødende, er blevet observeret i 9-33% af tilfældene, så case fremhæver vigtigheden af dets anerkendelse og styring, hvilket ofte er en udfordring.28
Konklusioner
Diagnosen PRES kræver en høj klinisk og billeddannende mistanke. Rettidig behandling med kontrol af symptomerne og den underliggende årsag ratificerer diagnosen under opfølgningen med opløsning af kliniske og billeddannende ændringer; ellers kan det forårsage neurologiske følgevirkninger eller død.
Interessekonflikt
Forfatterne erklærer, at de ikke har nogen interessekonflikt.