Introduzione
La sindrome da encefalopatia posteriore reversibile (PRES) è una rara complicanza di varie entità cliniche. La sua incidenza è sconosciuta, essendo stata segnalata in unampia fascia di età da 14 a 78 anni, con unetà media di 44 anni e un rapporto maschi / femmine di 0,8 / 1,1 Sebbene la prognosi sia generalmente favorevole, tassi di mortalità fino a 15 % sono stati segnalati.2 È determinato da manifestazioni clinico-radiologiche tipiche, solitamente transitorie.3 In forma acuta o subacuta, in ordine decrescente di frequenza si manifesta con encefalopatia, convulsioni, cefalea, disturbi visivi e deficit neurologico focale.4 Sono state postulate diverse teorie fisiopatologiche, due delle quali sono le più accettate. Il primo suggerisce che limprovviso aumento della pressione sanguigna supera lautoregolazione del flusso sanguigno cerebrale, causando vasodilatazione e iperperfusione, con rottura della barriera emato-encefalica (BBB) ed edema vasogenico.5 Quindi, è stato classicamente associato a eclampsia ed encefalopatia ipertensiva; tuttavia, il 20-30% dei pazienti è normoteso, suggerendo una seconda teoria della tossicità endoteliale diretta causata da mediatori dellinfiammazione, più correlata ai pazienti con trattamento immunosoppressivo, insufficienza renale, disturbi del tessuto connettivo o sepsi.6 Si verifica in 7 Risonanza magnetica ( MRI) del cervello è determinante per la diagnosi, mostrando edema vasogenico, solitamente nel territorio cerebrale posteriore, bilaterale e simmetrico.8 Poiché la diagnosi di PRES richiede un alto sospetto clinico e di imaging, con la successiva istituzione di un trattamento precoce per un favorevole prognosi; lobiettivo di questo lavoro è fornire informazioni per il riconoscimento e la gestione di questa insolita sindrome associata al LES.
Descrizione del caso
Una donna meticcia di 25 anni, di Quito, Ecuador, con patologia personale antecedenti di ipotiroidismo e LES, diagnosticati nel dicembre 2012, alletà di 21 anni. Nel dicembre 2016, 4 anni dopo la diagnosi di LES, presentava una riacutizzazione innescata da una malattia diarroica acuta; con manifestazioni muscoloscheletriche (artrite, mialgie) e mucocutanee (ulcere orali), sierosite (versamento pleurico destro), bicitopenia (anemia, trombocitopenia), coinvolgimento renale (ematuria, proteinuria, insufficienza renale acuta, classificazione della rete di lesioni renali acute III) e ipertensione arteriosa (AHT); tutto ciò le ha conferito un alto SLEDAI (valore: 23). La biopsia renale riportava un lupus glomerulonefrite focale proliferativo di classe II, non corrispondente a unintensa attività lupus; senza variazioni attribuibili alla sindrome da antifosfolipidi, così come alla negatività di questi anticorpi. A causa del coinvolgimento multi-organo, ha ricevuto impulsi di 1 g di metilprednisolone per via endovenosa per 3 giorni, sostituzione di emoderivati, 6 sessioni di plasmaferesi, emodialisi, amlodipina 10 mg / giorno, atenololo 50 mg / giorno e micofenolato mofetile 1g / 12 ore per via orale, poiché presentava intolleranza gastrointestinale a dosi più elevate. Tre settimane dopo il ricovero ha presentato un miglioramento analitico e clinico accettabile con il trattamento e, pertanto, è stata indicata la sua dimissione dallospedale. Ventiquattro ore dopo, il paziente rientra con uno stato convulsivo. In caso di emergenza hanno avviato la gestione delle vie aeree, anticonvulsivanti per via endovenosa con diazepam 10 mg, midazolam 3 mg, fenitoina 1 ge trasferita allunità di terapia intensiva.
È stata richiesta una tomografia cranica, che non mostrava segni di ischemia o sanguinamento ; è stata osservata unipodensità occipitale destra senza effetto massa, e per questo motivo lordine degli esami è stato ampliato per identificarne leziologia. Sono state escluse cause metaboliche, infettive e farmacologiche. A causa di AHT difficile da controllare (fino a 190 / 100mmHg con pressione arteriosa media di 130mmHg), il paziente ha richiesto fino a 6 farmaci antipertensivi; atenololo 50 mg / 12 ore, losartan 100 mg / giorno, amlodipina 10 mg / giorno, doxazosina 2 mg / 6 ore tramite sondino nasogastrico e nitroprussiato per via endovenosa 50 mg / giorno e furosemide 20 mg / 6 ore. A causa della grave attività lupus (SLEDAI 21: convulsioni, ematuria, proteinuria, ipocomplementemia, anti-DNA, trombocitopenia), ha ricevuto nuovamente il trattamento con metilprednisolone 1g / 3 giorni. Lelettroencefalogramma non ha mostrato attività epilettiforme. È stata richiesta unangiorisonanza cerebrale in cui non sono stati riscontrati reperti compatibili con vasculite o trombosi del sistema nervoso centrale. La risonanza magnetica del cervello mostrava immagini tipiche di PRES (Fig.1), il cui sviluppo sarebbe stato correlato a LES esacerbato, AHT grave, lupus glomerulonefrite e uso di immunosoppressori, quindi è stata aggiunta nimodipina orale 60 mg / 6 h e i fattori trigger sono stati controllati .A causa del rischio di lupus indotto da farmaci, la fenitoina è stata gradualmente sospesa, con aumento progressivo del levetiracetam fino a 1 g / 12 h tramite sondino nasogastrico. La tabella 1 riporta in dettaglio gli studi complementari pertinenti. Durante il follow-up, non ha presentato nuovi eventi convulsivi, la funzione renale è rimasta stazionaria, i valori della pressione sanguigna sono migliorati (MAP 85-90 mmHg) e lattività del lupus è diminuita (SLEDAI 13: ematuria, proteinuria, ipocomplementemia, anti-DNA , trombocitopenia). La risonanza magnetica del cervello di controllo ha evidenziato linvoluzione delle lesioni precedenti (Fig. 2).
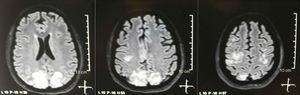
Risonanza magnetica nucleare semplice + diffusione del cervello al ricovero: lesioni bilaterali, simmetriche, iperintense nella sequenza FLAIR nella sostanza bianca dei lobi occipitali e parietali.
Studi complementari pertinenti del caso.
| Data | Test clinici |
|---|---|
| Esacerbazione di SLE 4 anni dopo la diagnosi | HB: emoglobina 7 mg / dl; ematocrito 22,2%; piastrine 75.000 / μl di proteina reattiva C: 2,52 mg / dl; procalcitonina 0,348 ng / ml Creatinina 5,7 mg / dl (eGFR CKD-EPI: 9,6 ml / min / 1,73 m2); urea 187mg / dl Creatina chinasi: 18U / l; lattato deidrogenasi: 237U / lMU: proteine 150mg / dl; globuli rossi 40,8 / campo; proteinuria: 1452 mg / 24 hC3: 36 mg / dl; C4: 15 mg / dl; anti-dsDNA: 200 UI / ml Lupus anticoagulante, anticardiolipine, beta 2-glicoproteina 1: negativo Biopsia renale; lupus focale proliferativo glomerulonefrite di classe II (ISN / RPS) con indice di cronicità e attività di 4 |
| Riammissione | HB: emoglobina 8,90 mg / dl; ematocrito 26,3%; piastrine 130.000 / μl Creatinina 2,77 mg / dl (eGFR CKD-EPI: 22,8 ml / min / 1,73 m2); urea 105,1 mg / dl Lattato deidrogenasi: 527U / l; γ-glutamil transferasi 79U / l; fosfatasi alcalina: 138U / l; bilirubina totale: 1,23 mg / dl; diretto: 0,50 mg / dl; indiretto: 0,73 mg / dl MU: proteine 300 mg / dl; globuli rossi 44 / campo; proteinuria 1974 mg / 24 ore Tomografia cranica semplice: ipodensità occipitale destra, senza effetto massa. Nessun segno di ischemia o sanguinamento Elettroencefalogramma: attività cerebrale di fondo a 4 Hz con ritmo theta a bassa tensione. Presenza di onde acute ai vertici con ritmi delta posteriori con simmetria interemisferica, senza attività epilettiforme parossistica Angiografia a risonanza magnetica del cervello nelle fasi arteriosa e venosa: senza alterazioni vascolari |
Anti-dsDNA: anti-DNA a doppia elica; HB: biometria ematica; MU: analisi microscopica delle urine; ISN / RPS: International Society of Nephrology / Renal Pathology Society; LES: lupus eritematoso sistemico; eGFR CKD-EPI: velocità di filtrazione glomerulare stimata utilizzando lequazione della Chronic Kidney Disease-Epidemiology Collaboration.
Discussione
Dalla prima descrizione del PRES, fatta nel 1996 da Hinchey et al., la conoscenza di diversi aspetti di questa entità è stata ampliata. Il suo nome originale di sindrome da leucoencefalopatia posteriore reversibile è risultato inappropriato, poiché i cambiamenti di imaging non sono sempre limitati alla sostanza bianca cerebrale e le sue manifestazioni cliniche non sono sempre reversibili.9 I primi 15 casi riportati si sono verificati in pazienti con encefalopatia ipertensiva, eclampsia o in regime immunosoppressivo. trattamento.10 È stato anche osservato come una complicanza di altre entità come sepsi, insufficienza renale e disturbi del tessuto connettivo; pertanto, è attualmente noto che i fattori di rischio che causano la disfunzione endoteliale sono fondamentali per lo sviluppo della PRES.11 Lincidenza globale non è nota, ma i dati di studi retrospettivi indicano che è più frequente negli individui tra i 39 ei 47 anni, generalmente donne, con comorbidità come disturbi ipertensivi, renali o autoimmuni.12 Nei pazienti con LES, molti autoanticorpi sono diretti contro lendotelio; producendo la sua attivazione, espressione di molecole di adesione (E-selectina, VCAM-1, ICAM-1) e lesposizione a citochine proinfiammatorie come IL-1β, TNFα e IL-6, causando interruzione del BBB e comparsa di complicanze neurologiche.13 È stato riportato che nelle persone con diagnosi di LES, la PRES si manifesta nel contesto di unattività lupus da moderata a grave, nonché associata a insufficienza renale e ipertensione scarsamente controllata.14
Per quanto riguarda le manifestazioni cliniche della PRES, è caratterizzata da gradi variabili di encefalopatia, dalla confusione allo stupore (50-80%), convulsioni (60-75%), cefalea (50%) e disturbi visivi che vanno dalla visione offuscata alla cecità corticale (33%); essendo insolito il deficit neurologico focale (10-15%) e lo stato epilettico (5-15%) .15 Per la valutazione iniziale della compromissione neurologica in questi pazienti, di solito è richiesta una tomografia assiale computerizzata (TC) cranica, che è spesso normale o può mostrare ipodensità corticale-sottocorticale, prevalentemente nelle regioni cerebrali posteriori.16 La risonanza magnetica del cervello determina la diagnosi, mostrando edema vasogenico, di solito nella sostanza bianca dei lobi occipitali e parietali (territorio della circolazione cerebrale posteriore) , visualizzate come lesioni iperintense in T2 e FLAIR, bilaterali e simmetriche.17 Il coinvolgimento preferenziale della sostanza bianca è dovuto alla sua struttura di fibre mieliniche, arteriole e capillari che le conferisce maggiore lassità. Allo stesso modo, i vasi della circolazione cerebrale anteriore, dotati di maggiore innervazione simpatica, possono rispondere adeguatamente per vasocostrizione allimprovviso aumento del flusso sanguigno cerebrale secondario allipertensione; un meccanismo protettivo meno sviluppato nel sistema vertebro-basilare.18 Meno frequentemente, la materia grigia e altri lobi possono essere colpiti. Le immagini con sequenze di diffusione permettono di distinguere tra ledema vasogenico, tipico della PRES, e ledema citotossico che può manifestarsi atipico e può progredire fino allinfarto.19 Lelettroencefalogramma non è sempre correlato allaffettività neurologica, ma può rivelare encefalopatia da la presenza di onde nitide focali. Nei pazienti con crisi associate a PRES, la principale alterazione elettroencefalografica è il generale rallentamento delle frequenze theta / delta.20 Lanalisi del liquido cerebrospinale mostra cambiamenti aspecifici come un leggero aumento della cellularità e delle proteine, e quindi è utile quando è convenienti per escludere uninfezione del sistema nervoso centrale.21 Oltre ai suddetti test, quelli ritenuti necessari per la diagnosi differenziale, principalmente con neurolupus, encefalopatia metabolica e parainfettiva, encefalite, infarto dellarteria cerebrale posteriore e disturbi demielinizzanti deve essere eseguita.22,23 Sulla base di quanto precede, la Fig. 3 mostra lalgoritmo proposto da Fugate et al. per la diagnosi di PRES, che mira a identificare casi anche atipici.15
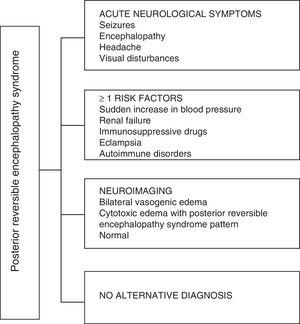
Algoritmo diagnostico per la sindrome da encefalopatia posteriore reversibile.
Nel nostro paziente, data la presentazione clinica insieme ai molteplici fattori di rischio, risultati di imaging ed esclusione di altre eziologie, la diagnosi di PRES è stata concluso. È stato istituito tempestivamente il trattamento sintomatico con farmaci anticonvulsivanti ed edema anti-cerebrale, insieme al controllo dei fattori causali: ipertensione grave, LES con attività grave, lupus glomerulonefrite, farmaci immunosoppressori; ratificare la diagnosi durante il follow-up con la risoluzione delle alterazioni cliniche e di imaging. Per quanto riguarda la gestione della PRES, la pressione sanguigna dovrebbe essere ridotta, le convulsioni dovrebbero essere trattate e il trigger dovrebbe essere controllato. La rapida diminuzione della pressione sanguigna potrebbe causare ischemia cerebrale, motivo per cui si suggerisce un obiettivo di una pressione sanguigna media compresa tra 105 e 125 mmHg, senza superare il 25% di questa riduzione nella prima ora. I farmaci di prima linea sono i bloccanti dei canali del calcio (nicardipina o nimodipina a scelta, che prevengono anche il vasospasmo cerebrale) o beta-bloccanti (ad esempio, labetalolo). Il nitroprussiato di sodio o lidralazina possono essere usati come farmaci di seconda linea. La nitroglicerina dovrebbe essere evitata a causa del suo effetto vasodilatatore, che aumenterebbe ledema cerebrale.24 Il trattamento delle crisi è simile a quello di altre crisi epilettiche. Le benzodiazepine come il lorazepam o il diazepam sono utilizzate come terapia di prima linea. Come seconda linea, fenitoina o valproato, specialmente nello stato epilettico o fenobarbital. Il solfato di magnesio può essere utilizzato nelle donne in gravidanza. Nelle crisi refrattarie, possiamo somministrare propofol o pentobarbital.25 I farmaci che potrebbero causare lupus indotto da farmaci, come idralazina, metildopa, captopril, fenitoina, valproato e carbamazepina, dovrebbero essere evitati nei pazienti con LES. Vi è controversia sulla gestione dei farmaci immunosoppressori nel trattamento della PRES in pazienti con LES.26 Dopo la risoluzione della PRES, le crisi sono poco frequenti e, pertanto, si dovrebbe considerare di sospendere gli anticonvulsivanti fintanto che vi è un adeguato controllo i fattori di rischio.27 Con un trattamento tempestivo e adeguato, la maggior parte dei pazienti con PRES evolve in modo soddisfacente con la remissione dei sintomi e le lesioni di imaging in pochi giorni o settimane, sebbene nel 9-33% dei casi siano state osservate complicanze, specialmente emorragiche, Il caso evidenzia limportanza del suo riconoscimento e della sua gestione, che è spesso una sfida.28
Conclusioni
La diagnosi di PRES richiede un alto sospetto clinico e di imaging. Il trattamento tempestivo con controllo dei sintomi e della causa sottostante ratifica la diagnosi durante il follow-up, con la risoluzione delle alterazioni cliniche e di imaging; in caso contrario, può causare sequele neurologiche o morte.
Conflitto di interessi
Gli autori dichiarano di non avere alcun conflitto di interessi.