Introducere
Sindromul de encefalopatie reversibilă posterioară (PRES) este o complicație rară a diferitelor entități clinice. Incidența sa este necunoscută, fiind raportată la o gamă largă de vârste de la 14 la 78 de ani, cu o vârstă medie de 44 de ani și un raport bărbat / femeie de 0,8 / 1,1 Deși prognosticul este de obicei favorabil, ratele de mortalitate de până la 15 ani % au fost raportate.2 Acesta este determinat de manifestări clinico-radiologice tipice, de obicei tranzitorii.3 Fie într-o formă acută sau subacută, în ordinea descrescătoare a frecvenței apare cu encefalopatie, convulsii, cefalee, tulburări vizuale și deficit neurologic focal.4 Au fost postulate mai multe teorii fiziopatologice, două fiind cele mai acceptate. Primul sugerează că creșterea bruscă a tensiunii arteriale depășește autoreglarea fluxului sanguin cerebral, provocând vasodilatație și hiperperfuzie, cu ruperea barierei hematoencefalice (BBB) și edem vasogen.5 Astfel, a fost asociat clasic cu eclampsie și encefalopatie hipertensivă; cu toate acestea, 20-30% dintre pacienți sunt normotensivi, sugerând o a doua teorie a toxicității endoteliale directe cauzată de mediatori inflamatori, mai corelată cu pacienții cu tratament imunosupresor, insuficiență renală, tulburări ale țesutului conjunctiv sau sepsis.6 Apare în 7 imagistică prin rezonanță magnetică ( RMN) al creierului este determinant pentru diagnostic, prezentând edem vasogen, de obicei în teritoriul cerebral posterior, bilateral și simetric.8 Deoarece diagnosticul PRES necesită o suspiciune clinică și imagistică ridicată, cu stabilirea ulterioară a unui tratament precoce pentru un tratament favorabil prognoză; obiectivul acestei lucrări este de a oferi informații pentru recunoașterea și gestionarea acestui sindrom neobișnuit asociat cu LES.
Descrierea cazului
O femeie mestiză de 25 de ani, din Quito, Ecuador, cu probleme patologice personale antecedente de hipotiroidism și LES, diagnosticate în decembrie 2012, la vârsta de 21 de ani. În decembrie 2016, la 4 ani de la diagnosticul LES, ea a prezentat o exacerbare declanșată de boala diareică acută; cu manifestări musculo-scheletice (artrită, mialgii) și mucocutane (ulcere orale), serozită (revărsat pleural drept), bicitopenie (anemie, trombocitopenie), afectare renală (hematurie, proteinurie, insuficiență renală acută, clasificare rețea a leziunilor acute ale rinichilor III) și hipertensiune arterială (AHT); toate acestea i-au conferit un mare SLEDAI (valoare: 23). Biopsia renală a raportat lupus glomerulonefrita proliferativă focală clasa II, care nu corespunde cu activitate intensă a lupusului; fără modificări atribuite sindromului antifosfolipidic, precum și negativitatea acestor anticorpi. Datorită implicării multi-organe, a primit impulsuri de 1 g de metilprednisolon intravenos timp de 3 zile, înlocuirea produselor din sânge, 6 ședințe de plasmafereză, hemodializă, amlodipină 10 mg / zi, atenolol 50 mg / zi și micofenolat mofetil 1 g / 12 ore pe cale orală, deoarece ea a prezentat intoleranță gastro-intestinală la doze mai mari. La trei săptămâni de la internare, ea a prezentat îmbunătățiri analitice și clinice acceptabile cu tratamentul și, prin urmare, i s-a indicat externarea. Douăzeci și patru de ore mai târziu, pacientul reintră cu un statut convulsiv. În situații de urgență, au inițiat managementul căilor respiratorii, anticonvulsivante intravenoase cu diazepam 10 mg, midazolam 3 mg, fenitoină 1 g și au transferat-o la secția de terapie intensivă. ; s-a observat o hipodensitate occipitală dreaptă fără efect de masă și din acest motiv ordinea examenelor a fost extinsă pentru a identifica etiologia acesteia. Au fost excluse cauzele metabolice, infecțioase și farmacologice. Datorită AHT dificil de controlat (până la 190 / 100mmHg cu o presiune arterială medie de 130mmHg), pacientul a necesitat până la 6 medicamente antihipertensive; atenolol 50mg / 12h, losartan 100mg / zi, amlodipină 10mg / zi, doxazosin 2mg / 6h prin tub nazogastric și nitroprusidă intravenoasă 50mg / zi și furosemid 20mg / 6h. Datorită activității lupusului sever (SLEDAI 21: convulsii, hematurie, proteinurie, hipocomplementemie, anti-ADN, trombocitopenie), a primit din nou tratament cu metilprednisolonă 1g / 3 zile. Electroencefalograma nu a prezentat activitate epileptiformă. S-a solicitat o angiorezonanță cerebrală în care nu au fost găsite rezultate consistente cu vasculită sau tromboză a sistemului nervos central. RMN-ul creierului a prezentat imagini tipice ale PRES (Fig. 1), a căror dezvoltare ar fi legată de LES exacerbat, AHT sever, lupus glomerulonefrita și utilizarea imunosupresoarelor, astfel încât s-a adăugat nimodipină orală 60mg / 6h și factorii declanșatori au fost controlați .Datorită riscului de lupus indus de medicamente, fenitoina a fost retrasă treptat, cu creșterea progresivă a levetiracetamului până la 1g / 12h prin sonda nazogastrică. Tabelul 1 detaliază studiile complementare relevante. În timpul urmăririi, ea nu a prezentat noi evenimente convulsive, funcția renală a rămas staționară, valorile tensiunii arteriale s-au îmbunătățit (MAP 85-90mmHg) și activitatea lupusului a scăzut (SLEDAI 13: hematurie, proteinurie, hipocomplementemie, anti-ADN , trombocitopenie). RMN-ul creierului de control a evidențiat implicarea leziunilor anterioare (Fig. 2).
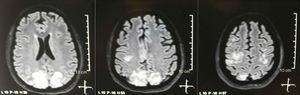
Imagistica prin rezonanță magnetică nucleară simplă + difuzie a creierului la admitere: leziuni bilaterale, simetrice, hiperintense în secvența FLAIR în substanța albă a lobilor occipitali și parietali.
Studii complementare relevante ale cazului.
| Data | Teste clinice |
|---|---|
| Exacerbarea SLE 4 ani după diagnostic | HB: hemoglobină 7mg / dl; hematocrit 22,2%; trombocite 75.000 / μlC proteină reactivă: 2,52mg / dl; procalcitonină 0,348ng / ml Creatinină 5,7mg / dl (eGFR CKD-EPI: 9,6ml / min / 1,73m2); uree 187mg / dl Creatin kinază: 18U / l; lactat dehidrogenază: 237U / lMU: proteine 150mg / dl; globule roșii 40,8 / câmp; proteinurie: 1452mg / 24hC3: 36mg / dl; C4: 15 mg / dl; anti-dsADN: 200 UI / ml Anticoagulant lupus, anticardiolipine, beta 2-glicoproteină 1: negativ Biopsie renală; glomerulonefrita proliferativă focală clasa II (ISN / RPS) cu un indice de cronicitate și activitate de 4 |
| Readmisie | HB: hemoglobină 8,90 mg / dl; hematocrit 26,3%; trombocite 130.000 / μl Creatinină 2,77 mg / dl (eGFR CKD-EPI: 22,8 ml / min / 1,73 m2); uree 105,1mg / dl Lactat dehidrogenază: 527U / l; γ-glutamil transferază 79U / l; fosfatază alcalină: 138U / l; bilirubină totală: 1,23mg / dl; direct: 0,50mg / dl; indirect: 0,73 mg / dl UM: proteine 300 mg / dl; globule roșii 44 / câmp; proteinurie 1974mg / 24h Tomografie craniană simplă: hipodensitate occipitală dreaptă, fără efect de masă. Nu există semne de ischemie sau sângerare Electroencefalogramă: activitate cerebrală de fond la 4Hz în ritm theta de joasă tensiune. Prezența undelor ascuțite ale vertexului cu ritmuri delta posterioare cu simetrie interhemisferică, fără activitate epileptiformă paroxistică Angiografie prin rezonanță magnetică a creierului în faze arteriale și venoase: fără modificări vasculare |
Anti-dsDNA: ADN anti-dublu catenar; HB: biometrie hematică; MU: analiza microscopică a urinei; ISN / RPS: Societatea Internațională de Nefrologie / Societatea de Patologie Renală; LES: lupus eritematos sistemic; eGFR CKD-EPI: rata de filtrare glomerulară estimată utilizând ecuația Colaborării cu boala renală cronică-Epidemiologie.
Discuție
De la prima descriere a PRES, făcută în 1996 de Hinchey și colab., cunoașterea mai multor aspecte ale acestei entități a fost extinsă. Denumirea sa originală de sindrom de leucoencefalopatie posterioară reversibilă a rezultat necorespunzătoare, deoarece modificările imagistice nu sunt întotdeauna limitate la substanța albă cerebrală și manifestările sale clinice nu sunt întotdeauna reversibile.9 Primele 15 cazuri raportate au apărut la pacienții cu encefalopatie hipertensivă, eclampsie sau sub imunosupresoare. tratament.10 A fost observat, de asemenea, ca o complicație a altor entități, cum ar fi sepsis, insuficiență renală și tulburări ale țesutului conjunctiv; prin urmare, în prezent se știe că factorii de risc care cauzează disfuncție endotelială sunt cheia dezvoltării PRES.11 Incidența globală nu este cunoscută, dar datele studiilor retrospective indică faptul că este mai frecventă la indivizii între 39 și 47 de ani, în general femei, cu comorbidități precum tulburări hipertensive, renale sau autoimune.12 La pacienții cu LES, mulți autoanticorpi sunt direcționați împotriva endoteliului; producerea activării sale, exprimarea moleculelor de aderență (E-selectină, VCAM-1, ICAM-1) și expunerea la citokine proinflamatorii precum IL-1β, TNFα și IL-6, provocând perturbarea BBB și apariția complicațiilor neurologice. S-a raportat că la persoanele diagnosticate cu LES, PRES apare în contextul activității lupusului moderat până la sever, precum și asociat cu insuficiență renală și hipertensiune arterială slab controlată.14
În ceea ce privește manifestările clinice ale PRES, acesta se caracterizează prin grade variabile de encefalopatie, de la confuzie la stupoare (50-80%), convulsii (60-75%), cefalee (50%) și tulburări vizuale variind de la vedere încețoșată la orbire corticală (33%); fiind neobișnuit deficitul neurologic focal (10-15%) și starea epileptică (5-15%) 15. Pentru evaluarea inițială a compromisului neurologic la acești pacienți, se solicită de obicei o tomografie axială computerizată craniană (CT), care este adesea normală sau poate prezenta hipodensități cortico-subcorticale, predominant în regiunile cerebrale posterioare.16 RMN-ul creierului determină diagnosticul, prezentând edem vasogen, de obicei în substanța albă a lobilor occipitali și parietali (teritoriul circulației cerebrale posterioare) , vizualizate ca leziuni hiperintense în T2 și FLAIR, bilaterale și simetrice.17 Implicarea preferențială a substanței albe se datorează structurii sale de fibre mielinizate, arteriole și capilare care îi conferă o mai mare laxitate. În mod similar, vasele circulației cerebrale anterioare, având o inervație simpatică mai mare, pot răspunde în mod adecvat prin vasoconstricție la creșterea bruscă a fluxului sanguin cerebral secundar hipertensiunii; un mecanism de protecție mai puțin dezvoltat în sistemul vertebrobazilar.18 Mai rar, substanța cenușie și alți lobi pot fi afectați. Imaginile cu secvențe de difuzie permit să se facă distincția între edemul vasogen, tipic PRES, și edemul citotoxic care poate apărea atipic și poate evolua spre infarct.19 Electroencefalograma nu se corelează întotdeauna cu afectarea neurologică, dar poate dezvălui encefalopatie prin prezența undelor ascuțite focale. La pacienții cu convulsii asociate cu PRES, principala alterare electroencefalografică este încetinirea generală a frecvențelor teta / delta.20. Analiza lichidului cefalorahidian prezintă modificări nespecifice, cum ar fi o ușoară creștere a celularității și a proteinelor și, prin urmare, este utilă atunci când este convenabil pentru a exclude o infecție în sistemul nervos central.21 Pe lângă testele menționate anterior, cele care sunt considerate necesare pentru diagnosticul diferențial, în principal cu neurolupus, encefalopatie metabolică și parainfecțioasă, encefalită, infarctul arterei cerebrale posterioare și tulburări demielinizante Trebuie efectuat.22,23 Pe baza celor de mai sus, Fig. 3 prezintă algoritmul propus de Fugate și colab. pentru diagnosticul PRES, care are ca scop identificarea cazurilor chiar atipice.15
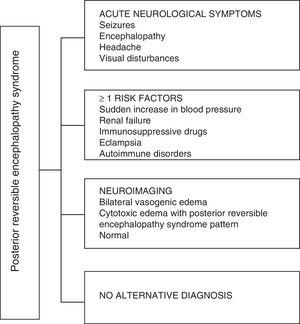
Algoritm de diagnostic pentru sindromul de encefalopatie posterioară reversibilă.
La pacientul nostru, având în vedere prezentarea clinică împreună cu multiplii factori de risc, constatări imagistice și excluderea altor etiologii, diagnosticul PRES a fost încheiat. Tratamentul simptomatic cu medicamente anticonvulsivante și edem anti-cerebral a fost instituit în timp util, împreună cu controlul factorilor cauzali: hipertensiune arterială severă, LES cu activitate severă, lupus glomerulonefrita, medicamente imunosupresoare; ratificarea diagnosticului în timpul urmăririi cu rezolvarea alterărilor clinice și imagistice. În ceea ce privește gestionarea PRES, tensiunea arterială trebuie redusă, convulsiile trebuie tratate și declanșatorul trebuie controlat. Scăderea rapidă a tensiunii arteriale ar putea provoca ischemie cerebrală, motiv pentru care este sugerat obiectivul unei tensiuni medii între 105 și 125mmHg, fără a depăși 25% din această reducere în prima oră. Medicamentele de primă linie sunt blocante ale canalelor de calciu (nicardipină sau nimodipină la alegere, care previne, de asemenea, vasospasmul cerebral) sau beta-blocante (de exemplu, labetalol). Nitroprusia de sodiu sau hidralazina pot fi utilizate ca medicamente de linia a doua. Nitroglicerina trebuie evitată datorită efectului său vasodilatator, care ar crește edemul cerebral.24 Tratamentul convulsiilor este similar cu cel al altor crize epileptice. Benzodiazepinele precum lorazepam sau diazepam sunt utilizate ca terapie de primă linie. Ca linia a doua, fenitoină sau valproat, în special în starea epileptică sau fenobarbital. Sulfatul de magneziu poate fi utilizat la femeile gravide. În convulsiile refractare, putem oferi propofol o pentobarbital.25 Medicamentele care ar putea provoca lupus indus de medicamente, cum ar fi hidralazina, metildopa, captoprilul, fenitoina, valproatul și carbamazepina, trebuie evitate la pacienții cu LES. Există controverse cu privire la gestionarea medicamentelor imunosupresoare în tratamentul PRES la pacienții cu LES.26 După rezolvarea PRES, convulsiile sunt rare și, prin urmare, ar trebui luată în considerare întreruperea anticonvulsivantelor, atâta timp cât există un control adecvat al factorii de risc.27 Cu un tratament adecvat în timp util, majoritatea pacienților cu PRES evoluează satisfăcător cu remisiunea simptomelor și a leziunilor imagistice în câteva zile sau săptămâni, deși au fost observate complicații, în special hemoragice, în 9-33% din cazuri, astfel încât acest lucru caz evidențiază importanța recunoașterii și gestionării sale, ceea ce este adesea o provocare.28
Concluzii
Diagnosticul PRES necesită o suspiciune clinică și imagistică ridicată. Tratamentul în timp util cu controlul simptomelor și a cauzei de bază ratifică diagnosticul în timpul urmăririi, cu rezolvarea modificărilor clinice și imagistice; în caz contrar, poate provoca sechele neurologice sau moartea.
Conflict de interese
Autorii declară că nu au niciun conflict de interese.