Introduksjon
Posterior reversibel encefalopati syndrom (PRES) er en sjelden komplikasjon fra ulike kliniske enheter. Forekomsten er ukjent, etter å ha blitt rapportert i et bredt spekter av aldre fra 14 til 78 år, med en gjennomsnittsalder på 44 år og et mannlig / kvinnelig forhold på 0,8 / 1,1 Selv om prognosen vanligvis er gunstig, er dødeligheten på opptil 15 % er rapportert.2 Det bestemmes av typiske kliniske – radiologiske manifestasjoner, vanligvis forbigående.3 Enten i akutt eller subakutt form, i fallende rekkefølge av frekvens, oppstår det med encefalopati, kramper, hodepine, synsforstyrrelser og fokal nevrologisk underskudd.4 Flere patofysiologiske teorier er blitt postulert, hvor to er de mest aksepterte. Den første antyder at den plutselige økningen i blodtrykk overstiger selvreguleringen av cerebral blodstrøm, forårsaker vasodilatasjon og hyperperfusjon, med brudd på blod-hjerne-barrieren (BBB) og vasogent ødem.5 Dermed har det vært klassisk assosiert med eklampsi og hypertensiv encefalopati; 20-30% av pasientene er imidlertid normotensive, noe som tyder på en andre teori om direkte endotel-toksisitet forårsaket av inflammatoriske mediatorer, mer korrelert til pasienter med immunsuppressiv behandling, nyresvikt, bindevevssykdommer eller sepsis.6 Det forekommer i 7 Magnetic resonance imaging ( MR) i hjernen er avgjørende for diagnosen, og viser vasogent ødem, vanligvis i bakre hjerneområde, bilateralt og symmetrisk.8 Siden diagnosen PRES krever en høy klinisk og bildende mistanke, med påfølgende etablering av tidlig behandling for en gunstig prognose; Målet med dette arbeidet er å gi informasjon for anerkjennelse og håndtering av dette uvanlige syndromet knyttet til SLE.
Beskrivelse av saken
En 25 år gammel mestizo-kvinne, fra Quito, Ecuador, med personlig patologisk antecedents of hypothyroidism and SLE, diagnostisert i desember 2012, i en alder av 21 år. I desember 2016, 4 år etter diagnosen SLE, presenterte hun en forverring utløst av akutt diarésykdom; med muskuloskeletale (artritt, myalgi) og slimhinne (orale sår) manifestasjoner, serositis (høyre pleural effusjon), bicytopeni (anemi, trombocytopeni), nyreengasjement (hematuri, proteinuri, akutt nyresvikt, klassifisering av akutt nyreskade nettverk III) og arteriell hypertensjon (AHT); som alle ga henne en høy SLEDAI (verdi: 23). Nyrebiopsien rapporterte fokal proliferativ lupus glomerulonefritt klasse II, ikke tilsvarende intens lupusaktivitet; uten endringer som kan tilskrives antifosfolipidsyndrom, samt negativitet av disse antistoffene. På grunn av multiorgan-involveringen fikk hun pulser av 1 g metylprednisolon intravenøst i 3 dager, erstatning av blodprodukter, 6 økter med plasmaferese, hemodyalisis, amlodipin 10 mg / dag, atenolol 50 mg / dag og mykofenolatmofetil 1 g / 12 t oralt, siden hun presenterte gastrointestinal intoleranse mot høyere doser. Tre uker etter innleggelse presenterte hun akseptabel analytisk og klinisk forbedring med behandlingen, og derfor ble sykehusutslipp indikert. 24 timer senere kommer pasienten tilbake med krampestatus. I nødstilfeller initierte de luftveishåndtering, intravenøse antikonvulsiva med diazepam 10 mg, midazolam 3 mg, fenytoin 1 g og overførte henne til intensivavdelingen.
Det ble bedt om en kranietomografi, som ikke viste tegn på iskemi eller blødning. ; en høyre occipital hypodensitet uten masseeffekt ble observert, og av denne grunn ble rekkefølgen av eksamen utvidet for å identifisere etiologien. Metabolske, smittsomme og farmakologiske årsaker ble ekskludert. På grunn av vanskelig å kontrollere AHT (opptil 190/100 mmHg med gjennomsnittlig arterietrykk på 130 mmHg), krevde pasienten opptil 6 antihypertensiva; atenolol 50 mg / 12 t, losartan 100 mg / døgn, amlodipin 10 mg / døgn, doxazosin 2 mg / 6 t via nasogastrisk rør og intravenøs nitroprussid 50 mg / døgn og furosemid 20 mg / 6 t. På grunn av alvorlig lupusaktivitet (SLEDAI 21: kramper, hematuri, proteinuri, hypokomplementemi, anti-DNA, trombocytopeni), fikk hun igjen behandling med metylprednisolon 1 g / 3 dager. Elektroencefalogrammet viste ikke epileptiform aktivitet. Det ble bedt om en cerebral angioresonans der funn i samsvar med vaskulitt eller trombose i sentralnervesystemet ikke ble funnet. MR i hjernen viste typiske bilder av PRES (fig. 1), hvis utvikling ville være relatert til den forverrede SLE, alvorlig AHT, lupus glomerulonefritt og bruk av immunsuppressiva, så oral nimodipin 60 mg / 6 t ble tilsatt og triggerfaktorene ble kontrollert .På grunn av risikoen for medikamentindusert lupus ble fenytoin gradvis trukket tilbake, med progressiv økning av levetiracetam opptil 1 g / 12 timer via nesesonde. Tabell 1 beskriver relevante komplementære studier. Under oppfølgingen presenterte hun ikke nye kramper, nyrefunksjonen holdt seg stille, blodtrykksverdiene ble bedre (MAP 85-90mmHg), og lupusaktiviteten reduserte (SLEDAI 13: hematuri, proteinuri, hypokomplementemi, anti-DNA , trombocytopeni). MR i kontrollens hjerne viste involvering av de tidligere lesjonene (fig. 2).
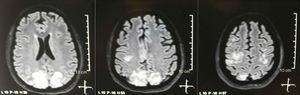
Enkel + diffusjon kjernemagnetisk resonansavbildning av hjernen ved opptak: bilaterale, symmetriske, hyperintense lesjoner i FLAIR-sekvens i hvitt materiale av occipital og parietal lober.
Relevante utfyllende studier av saken.
| Dato | Kliniske tester |
|---|---|
| Forverring av SLE 4 år etter diagnose | HB: hemoglobin 7 mg / dl; hematokrit 22,2%; blodplater 75.000 / μlC-reaktivt protein: 2,52 mg / dl; procalcitonin 0,348ng / ml Kreatinin 5,7 mg / dl (eGFR CKD-EPI: 9,6 ml / min / 1,73 m2); urea 187 mg / dl Kreatinkinase: 18 U / l; laktatdehydrogenase: 237U / lMU: proteiner 150 mg / dl; røde blodlegemer 40,8 / felt; proteinuria: 1452 mg / 24 hC3: 36 mg / dl; C4: 15 mg / dl; anti-dsDNA: 200 IU / ml Lupus antikoagulant, antikardiolipiner, beta 2-glykoprotein 1: negativ Renal biopsi; focal lupus proliferativ glomerulonefritt klasse II (ISN / RPS) med en kronisitets- og aktivitetsindeks på 4 |
| Reinnleggelse | HB: hemoglobin 8,90 mg / dl; hematokrit 26,3%; blodplater 130 000 / ul Kreatinin 2,77 mg / dl (eGFR CKD-EPI: 22,8 ml / min / 1,73 m2); urea 105,1 mg / dlLaktatdehydrogenase: 527U / l; y-glutamyltransferase 79U / l; alkalisk fosfatase: 138U / l; totalt bilirubin: 1,23 mg / dl; direkte: 0,50 mg / dl; indirekte: 0,73 mg / dlMU: proteiner 300 mg / dl; røde blodlegemer 44 / felt; proteinuria 1974 mg / 24 timer Enkel kranietomografi: høyre occipital hypodensitet, uten masseeffekt. Ingen tegn på iskemi eller blødning Elektroencefalogram: bakgrunn hjerneaktivitet ved 4Hz i lavspent theta-rytme. Tilstedeværelse av toppunkt skarpe bølger med posteriore deltarytmer med interhemisfærisk symmetri, uten paroksysmal epileptiform aktivitetMagnetisk resonansangiografi av hjernen i arterielle og venøse faser: uten vaskulære endringer |
Anti-dsDNA: anti-dobbeltstrenget DNA; HB: hematisk biometri; MU: mikroskopisk urinalyse; ISN / RPS: International Society of Nephrology / Renal Pathology Society; SLE: systemisk lupus erythematosus; eGFR CKD-EPI: glomerulær filtreringshastighet estimert ved bruk av ligningen til Chronic Kidney Disease-Epidemiology Collaboration.
Diskusjon
Siden den første beskrivelsen av PRES, laget i 1996 av Hinchey et al., har kunnskapen om flere aspekter av denne enheten blitt utvidet. Det opprinnelige navnet på reversibelt posteriort leukoencefalopatisyndrom førte til upassende, siden bildeforandringene ikke alltid er begrenset til cerebral hvit substans, og dens kliniske manifestasjoner er ikke alltid reversible.9 De første 15 rapporterte tilfellene skjedde hos pasienter med hypertensiv encefalopati, eclampsia eller under immunsuppressiv behandling.10 Det har også blitt observert som en komplikasjon fra andre enheter som sepsis, nyresvikt og bindevevssykdommer; derfor er det for tiden kjent at risikofaktorene som forårsaker endotel dysfunksjon er nøkkelen for utviklingen av PRES.11 Den globale forekomsten er ikke kjent, men data fra tilbakevirkende studier indikerer at det er hyppigere hos personer mellom 39 og 47 år, generelt kvinner med komorbiditeter som hypertensive, nyre- eller autoimmune lidelser. 12 Hos pasienter med SLE er mange autoantistoffer rettet mot endotel; produsere dets aktivering, ekspresjon av adhesjonsmolekyler (E-selectin, VCAM-1, ICAM-1) og eksponering for proinflammatoriske cytokiner som IL-1β, TNFα og IL-6, forårsaker forstyrrelse av BBB og fremkomst av nevrologiske komplikasjoner.13 Det er rapportert at PRES forekommer i sammenheng med moderat til alvorlig lupusaktivitet hos personer som er diagnostisert med SLE, så vel som assosiert med nyresvikt og dårlig kontrollert hypertensjon.14
Når det gjelder de kliniske manifestasjonene av PRES, er det preget av varierende grad av encefalopati, fra forvirring til dumhet (50-80%), kramper (60-75%), hodepine (50%) og synsforstyrrelser fra tåkesyn til kortikal blindhet (33%); å være uvanlig det fokale nevrologiske underskuddet (10–15%) og statusen epileptisk (5–15%). 15 For den første vurderingen av det nevrologiske kompromisset hos disse pasientene, blir det vanligvis bedt om en CT-skanning av hjernen (CT) er ofte normal eller kan vise kortikale – subkortikale hypodensiteter, hovedsakelig i bakre hjerneområder.16 MR i hjernen bestemmer diagnosen, viser vasogen ødem, vanligvis i det hvite stoffet i occipitale og parietale lapper (territorium til bakre hjerne sirkulasjon) , visualisert som hyperintense lesjoner i T2 og FLAIR, bilaterale og symmetriske.17 Den foretrukne involveringen av den hvite substansen skyldes dens struktur av myeliniserte fibre, arterioler og kapillærer som gir den større slapphet. Tilsvarende kan karene i den fremre hjernesirkulasjonen, som har større sympatisk innervering, tilstrekkelig reagere ved vasokonstriksjon til den plutselige økningen i hjerneblodstrøm sekundær til hypertensjon; en beskyttelsesmekanisme som er mindre utviklet i vertebrobasilar-systemet.18 Sjeldnere kan gråstoffet og andre lapper påvirkes. Bildene med diffusjonssekvenser gjør det mulig å skille mellom det vasogene ødemet, typisk for PRES, og det cytotoksiske ødemet som kan forekomme atypisk og kan utvikle seg til infarkt.19 Elektroencefalogrammet korrelerer ikke alltid med den nevrologiske påvirkningen, men det kan avsløre encefalopati ved tilstedeværelsen av fokale skarpe bølger. Hos pasienter med kramper assosiert med PRES, er den viktigste elektroencefalografiske endringen den generelle bremsingen i theta / delta-frekvenser.20 Analysen av cerebrospinalvæsken viser uspesifikke endringer som en liten økning i cellularitet og proteiner, og derfor er det nyttig når det er praktisk å utelukke en infeksjon i sentralnervesystemet.21 I tillegg til de nevnte testene, de som anses som nødvendige for differensialdiagnosen, hovedsakelig med neurolupus, metabolsk og parainfektiøs encefalopati, encefalitt, infarkt i bakre hjernearterie og demyeliniserende lidelser må utføres. 22,23 Basert på det foregående viser figur 3 algoritmen foreslått av Fugate et al. for diagnosen PRES, som tar sikte på å identifisere til og med atypiske tilfeller.15
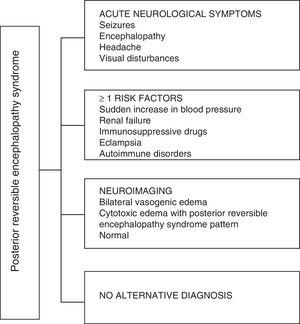
Diagnostisk algoritme for posterior reversibel encefalopatisyndrom.
Hos pasienten vår, gitt den kliniske presentasjonen sammen med flere risikofaktorer, bildefunn og utelukkelse av andre etiologier, var diagnosen PRES konkluderte. Symptomatisk behandling med antikonvulsiv medisinering og anti-cerebral ødem ble innledet i tide, sammen med kontrollen av årsaksfaktorene: alvorlig hypertensjon, SLE med alvorlig aktivitet, lupus glomerulonefritt, immunsuppressive medisiner; ratifisere diagnosen under oppfølgingen med oppløsningen av de kliniske og bildebehandlingene. Når det gjelder håndteringen av PRES, bør blodtrykket reduseres, anfallene behandles og avtrekkeren kontrolleres. Den raske reduksjonen i blodtrykk kan forårsake cerebral iskemi, og det er derfor et mål om et gjennomsnittlig blodtrykk mellom 105 og 125 mmHg foreslås uten å overstige 25% av denne reduksjonen i løpet av den første timen. Førstelinjemedisinene er kalsiumkanalblokkere (nikardipin eller nimodipin etter eget valg, som også forhindrer cerebral vasospasme) eller betablokkere (for eksempel labetalol). Natriumnitroprussid eller hydralazin kan brukes som andrelinjemedisiner. Nitroglyserin bør unngås på grunn av dets vasodilaterende effekt, noe som vil øke hjerneødemet.24 Behandlingen av anfallene er lik den for andre epileptiske anfall. Benzodiazepiner som lorazepam eller diazepam brukes som førstelinjebehandling. Som andre linje, fenytoin eller valproat, spesielt i status epilepticus, eller fenobarbital. Magnesiumsulfat kan brukes hos gravide kvinner. I ildfaste anfall kan vi gi propofol o pentobarbital.25 Legemidler som kan forårsake medikamentindusert lupus, slik som hydralazin, metyldopa, kaptopril, fenytoin, valproat og karbamazepin, bør unngås hos pasienter med SLE. Det er uenighet om håndtering av immunsuppressive medikamenter ved behandling av PRES hos pasienter med SLE.26 Etter oppløsningen av PRES er anfall sjeldne, og det bør derfor vurderes å avbryte antikonvulsiva så lenge det er tilstrekkelig kontroll med risikofaktorene.27 Med en betimelig og tilstrekkelig behandling utvikler flertallet av pasienter med PRES tilfredsstillende med remisjon av symptomene og bildeskader i løpet av få dager eller uker, selv om komplikasjoner, spesielt blødende, har blitt observert i 9–33% av tilfellene, så dette saken fremhever viktigheten av anerkjennelse og håndtering, noe som ofte er en utfordring.28
Konklusjoner
Diagnosen PRES krever en høy klinisk mistanke. Tidlig behandling med kontroll av symptomene og den underliggende årsaken ratifiserer diagnosen under oppfølging, med oppløsning av kliniske og bildebehandlingsendringer; ellers kan det forårsake nevrologiske følgevirkninger eller død.
Interessekonflikt
Forfatterne erklærer at de ikke har noen interessekonflikt.