はじめに
可逆性後頭葉脳症症候群(PRES)は、さまざまな臨床実体のまれな合併症です。その発生率は不明であり、14歳から78歳までの幅広い年齢で報告されており、平均年齢は44歳、男性/女性比は0.8 / 1.1です。予後は通常良好ですが、死亡率は最大15です。 %が報告されています。2これは、通常は一過性の典型的な臨床放射線学的症状によって決定されます。3急性または亜急性のいずれかで、頻度の高い順に、脳症、発作、頭痛、視覚障害、および限局性神経障害で発生します。4いくつかの病態生理学的理論が仮定されており、2つが最も受け入れられています。最初のものは、血圧の突然の上昇が脳血流の自己調節を超え、血液脳関門(BBB)の破裂と血管原性浮腫を伴う血管拡張と高血圧を引き起こすことを示唆しています5。したがって、それは古典的に子癇および高血圧性脳症;ただし、患者の20〜30%は正常血圧であり、炎症性メディエーターによって引き起こされる直接的な内皮毒性の2番目の理論を示唆しており、免疫抑制治療、腎不全、結合組織障害、または敗血症の患者とより相関しています6。7磁気共鳴画像法で発生します(脳のMRI)は診断の決定要因であり、血管原性浮腫を示し、通常は後大脳領域で、両側性で対称的です8。PRESの診断には高い臨床的および画像的疑いが必要であるため、その後、良好な治療のための早期治療を確立します。予後;この研究の目的は、SLEに関連するこの異常な症候群の認識と管理のための情報を提供することです。
症例の説明
エクアドルのキト出身の25歳のメスティゾ女性。 2012年12月に21歳で診断された甲状腺機能低下症およびSLEの前兆。 SLEの診断から4年後の2016年12月、彼女は急性下痢性疾患によって引き起こされた悪化を示しました。筋骨格系(関節炎、筋痛)および粘膜皮膚系(口腔潰瘍)の症状、漿膜炎(右胸水)、二細胞減少症(貧血、血小板減少症)、腎障害(血尿、タンパク尿、急性腎不全、急性腎障害ネットワーク分類III)および動脈肥大を伴う(AHT);そのすべてが彼女に高いSLEDAI(値:23)を与えました。腎生検は、限局性増殖性ループス糸球体腎炎クラスIIを報告しましたが、激しいループス活動には対応していません。抗リン脂質抗体症候群に起因する変化、およびこれらの抗体の陰性。多臓器の関与により、彼女は1gのメチルプレドニゾロンのパルスを3日間静脈内投与し、血液製剤の交換、6回の血漿交換、血液透析、アムロジピン10mg /日、アテノロール50mg /日、ミコフェノール酸モフェチル1g / 12hを経口投与しました。彼女は高用量に対して胃腸不耐性を示した。入院の3週間後、彼女は治療により許容できる分析的および臨床的改善を示したため、彼女の退院が示されました。 24時間後、患者はけいれん状態で再び入ります。緊急時には、気道管理、ジアゼパム10mg、ミダゾラム3mg、フェニトイン1gの静脈内抗けいれん薬を開始し、彼女を集中治療室に移送しました。
虚血や出血の兆候を示さない頭蓋断層撮影が要求されました。 ;質量効果のない右後頭低密度が観察されたため、その病因を特定するために検査の順序が拡大されました。代謝的、感染的および薬理学的原因は除外されました。 AHTの制御が難しいため(平均動脈圧130mmHgで最大190 / 100mmHg)、患者は最大6つの降圧薬を必要としました。アテノロール50mg / 12h、ロサルタン100mg /日、アムロジピン10mg /日、経鼻胃管経由のドキサゾシン2mg / 6h、ニトロプルシド50mg /日およびフロセミド20mg / 6hの静脈内投与。重度の狼瘡活動(SLEDAI 21:発作、血尿、タンパク尿、低補体血症、抗DNA、血小板減少症)のため、彼女は再びメチルプレドニゾロン1g / 3日で治療を受けました。脳波はてんかん様活動を示さなかった。中枢神経系の血管炎または血栓症と一致する所見が見つからなかった脳血管共鳴が要求された。脳のMRIはPRESの典型的な画像を示し(図1)、その発達は悪化したSLE、重度のAHT、ループス糸球体腎炎および免疫抑制剤の使用に関連しているため、経口ニモジピン60mg / 6hを追加し、トリガー因子を制御しました。薬剤誘発性ループスのリスクがあるため、フェニトインは徐々に中止され、経鼻胃管を介してレベチラセタムが1g / 12時間まで徐々に増加しました。表1に、関連する補足研究の詳細を示します。フォローアップ中、彼女は新たなけいれんイベントを示さず、腎機能は静止したままで、血圧値は改善し(MAP 85–90mmHg)、ループス活動は減少しました(SLEDAI 13:血尿、タンパク尿、低補体血症、抗DNA 、血小板減少症)。コントロールの脳のMRIは、以前の病変の退縮を証明しました(図2)。
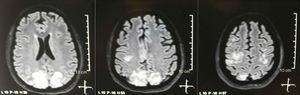
入院時の脳の単純+拡散核磁気共鳴画像法:後頭葉および頭頂葉の白質におけるFLAIRシーケンスの両側性の対称的な高信号病変。
ケースの関連する補足的研究。
| 日付 | 臨床検査 |
|---|---|
| SLE4年の悪化診断後 | HB:ヘモグロビン7mg / dl;ヘマトクリット22.2%;血小板75,000 /μlC反応性タンパク質:2.52mg / dl;プロカルシトニン0.348ng / mlクレアチニン5.7mg / dl(eGFR CKD-EPI:9.6ml / min / 1.73m2);尿素187mg / dlクレアチンキナーゼ:18U / l;乳酸デヒドロゲナーゼ:237U / lMU:タンパク質150mg / dl;赤血球40.8 /フィールド;タンパク尿:1452mg / 24hC3:36mg / dl; C4:15mg / dl;抗dsDNA:200IU / mlLupus抗凝固剤、抗カルジオリピン、ベータ2-糖タンパク質1:陰性腎生検;慢性および活動指数が4の限局性ループス増殖性糸球体腎炎クラスII(ISN / RPS) |
| 再入院 | HB:ヘモグロビン8.90mg / dl;ヘマトクリット26.3%;血小板130,000 /μlクレアチニン2.77mg / dl(eGFR CKD-EPI:22.8ml / min / 1.73m2);尿素105.1mg / dl乳酸デヒドロゲナーゼ:527U / l; γ-グルタミルトランスフェラーゼ79U / l;アルカリホスファターゼ:138U / l;総ビリルビン:1.23mg / dl;直接:0.50mg / dl;間接:0.73mg / dlMU:タンパク質300mg / dl;赤血球44 /フィールド;タンパク尿1974mg / 24h単純な頭蓋断層撮影:質量効果のない右後頭低密度。虚血または出血の兆候なし脳波:低電圧シータリズムでの4Hzでのバックグラウンド脳活動。発作性てんかん様活動を伴わない、半球間対称性を伴う後部デルタリズムを伴う頂点の鋭い波の存在動脈および静脈相における脳の磁気共鳴血管造影:血管の変化なし |
Anti-dsDNA:抗二本鎖DNA; HB:ヘマティックバイオメトリ; MU:顕微鏡的尿検査; ISN / RPS:国際腎臓学会/腎病理学会; SLE:全身性エリテマトーデス; eGFR CKD-EPI:慢性腎臓病-疫学コラボレーションの方程式を使用して推定された糸球体濾過率。
ディスカッション
1996年にHincheyet al。によって作成されたPRESの最初の説明以来、このエンティティのいくつかの側面に関する知識が広がりました。可逆性後頭白質脳症症候群の元の名前は、画像の変化が必ずしも脳白質に限定されず、その臨床症状が常に可逆的であるとは限らないため、不適切でした9。報告された最初の15例は、高血圧性脳症、子癇、または免疫抑制下の患者で発生しました。治療10。敗血症、腎不全、結合組織障害などの他の実体の合併症としても観察されています。したがって、内皮機能障害を引き起こす危険因子がPRESの発症の鍵であることが現在知られています11。世界的な発生率は不明ですが、後ろ向き研究のデータは、一般的に39〜47歳の個人でより頻繁であることを示しています高血圧、腎障害、自己免疫疾患などの併存疾患のある女性。12SLEの患者では、多くの自己抗体が内皮に対して向けられています。その活性化、接着分子(E-セレクチン、VCAM-1、ICAM-1)の発現、およびIL-1β、TNFα、IL-6などの炎症誘発性サイトカインへの曝露を引き起こし、BBBの破壊と神経学的合併症の出現を引き起こします。 SLEと診断された人々では、PRESは中等度から重度の狼瘡活動の状況で発生し、腎不全や制御不良の高血圧に関連していることが報告されています。14
PRESの臨床症状に関しては、錯乱から昏迷(50〜80%)、発作(60〜75%)、頭痛(50%)、およびさまざまな程度の脳症が特徴です。かすみ目から皮質盲までの範囲の視覚障害(33%);異常な限局性神経障害(10〜15%)およびてんかん状態(5〜15%)15。これらの患者の神経障害の初期評価には、通常、頭蓋コンピュータ断層撮影(CT)スキャンが要求されます。多くの場合、正常であるか、主に後脳領域で皮質-皮質下低密度を示す可能性があります16。脳のMRIが診断を決定し、通常は後頭葉および頭頂葉(後大脳循環の領域)の白質に血管原性浮腫を示します。 、T2およびFLAIRで高信号の病変として視覚化され、両側性で対称的です。17白質の優先的な関与は、有髄線維、動脈および毛細血管の構造によるものであり、より大きな弛緩をもたらします。同様に、より大きな交感神経支配を有する前大脳循環の血管は、高血圧に続発する脳血流の突然の増加に対して血管収縮によって適切に応答することができる。椎骨脳底動脈系ではあまり発達していない保護メカニズム18。それほど頻繁ではないが、灰白質や他の葉が影響を受ける可能性がある。拡散シーケンスを含む画像により、PRESに典型的な血管原性浮腫と、非定型的に発生して梗塞に進行する可能性のある細胞毒性浮腫を区別できます19。脳波は必ずしも神経学的影響と相関しているわけではありませんが、脳症を明らかにする可能性があります。焦点の鋭い波の存在。 PRESに関連する発作のある患者では、主な脳波の変化はシータ/デルタ周波数の一般的な減速です20。脳脊髄液の分析では、細胞性やタンパク質のわずかな増加などの非特異的な変化が示されているため、中枢神経系の感染症を除外するのに便利です。21前述の検査に加えて、主に脳脊髄液、代謝性および傍感染性脳症、脳炎、後大脳動脈の梗塞および脱髄障害を伴う鑑別診断に必要と考えられる検査。上記に基づいて、図3はFugateらによって提案されたアルゴリズムを示しています。非定型のケースでも特定することを目的としたPRESの診断用。15
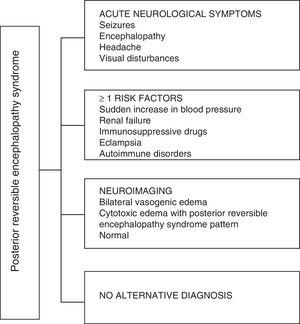
可逆性後頭葉脳症症候群の診断アルゴリズム。
私たちの患者では、複数の危険因子、画像所見、および他の病因の除外とともに臨床症状が見られたため、PRESの診断は結論。抗けいれん薬と抗脳浮腫による対症療法は、原因となる要因の制御とともに、適時に開始されました:重度の高血圧、重度の活動を伴うSLE、ループス糸球体腎炎、免疫抑制薬。フォローアップ中に診断を承認し、臨床および画像の変化を解決します。 PRESの管理に関しては、血圧を下げ、発作を治療し、トリガーを制御する必要があります。血圧の急激な低下は脳虚血を引き起こす可能性があるため、最初の1時間でこの低下の25%を超えることなく、105〜125mmHgの平均血圧の目標が提案されます。第一選択薬は、カルシウムチャネル遮断薬(ニカルジピンまたはニモジピンを選択し、脳血管れん縮も予防します)またはベータ遮断薬(たとえば、ラベタロール)です。ニトロプルシドナトリウムまたはヒドララジンは二次治療薬として使用できます。ニトログリセリンは、脳浮腫を増加させる血管拡張作用があるため、避ける必要があります24。発作の治療は、他のてんかん発作の治療と同様です。ロラゼパムやジアゼパムなどのベンゾジアゼピンが一次治療として使用されます。セカンドラインとして、特にてんかん重積状態のフェニトインまたはバルプロ酸、またはフェノバルビタール。硫酸マグネシウムは妊婦に使用できます。難治性発作では、プロポフォールまたはペントバルビタールを投与できます。25ヒドララジン、メチルドパ、カプトプリル、フェニトイン、バルプロ酸、カルバマゼピンなど、薬物誘発性狼瘡を引き起こす可能性のある薬物は、SLE患者では避ける必要があります。 SLE患者のPRESの治療における免疫抑制薬の管理については論争があります26。PRESの解決後、発作はまれであるため、適切な管理が行われている限り、抗けいれん薬を中止することを検討する必要があります。危険因子。27タイムリーで適切な治療により、PRESの患者の大多数は、数日または数週間で症状の寛解と病変の画像化を伴って十分に進展しますが、合併症、特に出血性の症例が9〜33%の症例で観察されているため、 症例は、その認識と管理の重要性を浮き彫りにしますが、これはしばしば課題となります。28
結論
PRESの診断には、高い臨床的および画像的疑いが必要です。 症状と根本的な原因を制御したタイムリーな治療は、臨床的および画像の変化を解決して、フォローアップ中に診断を承認します。 そうしないと、神経学的後遺症または死亡を引き起こす可能性があります。
利益相反
著者は利益相反がないことを宣言します。