Tensiunea superficială a apei este de aproximativ 72 mN / m la temperatura camerei, care este una dintre cele mai mari tensiuni superficiale pentru lichid. Există un singur lichid cu tensiune superficială mai mare și este mercurul, care este un metal lichid cu tensiunea superficială de aproape 500 mN / m. De ce tensiunea superficială a mercurului este atât de mare va fi, de asemenea, evidentă după citirea acestei scurte postări pe blog.
Tensiunea superficială ridicată a apei este cauzată de interacțiuni moleculare puternice
Tensiunea superficială apare datorită la interacțiuni coezive între moleculele din lichid. În cea mai mare parte a lichidului, moleculele au molecule vecine pe fiecare parte. Moleculele se trag reciproc în mod egal în toate direcțiile, provocând o forță netă de zero. Cu toate acestea, la interfață, moleculele lichide au doar jumătate din moleculele lichide învecinate în comparație cu cea mai mare parte a lichidului. Acest lucru face ca molecula să se asocieze mai puternic cu moleculele de pe laturile sale și provoacă o forță netă spre interior spre lichid. Această forță rezistă ruperii suprafeței și se numește tensiune superficială.
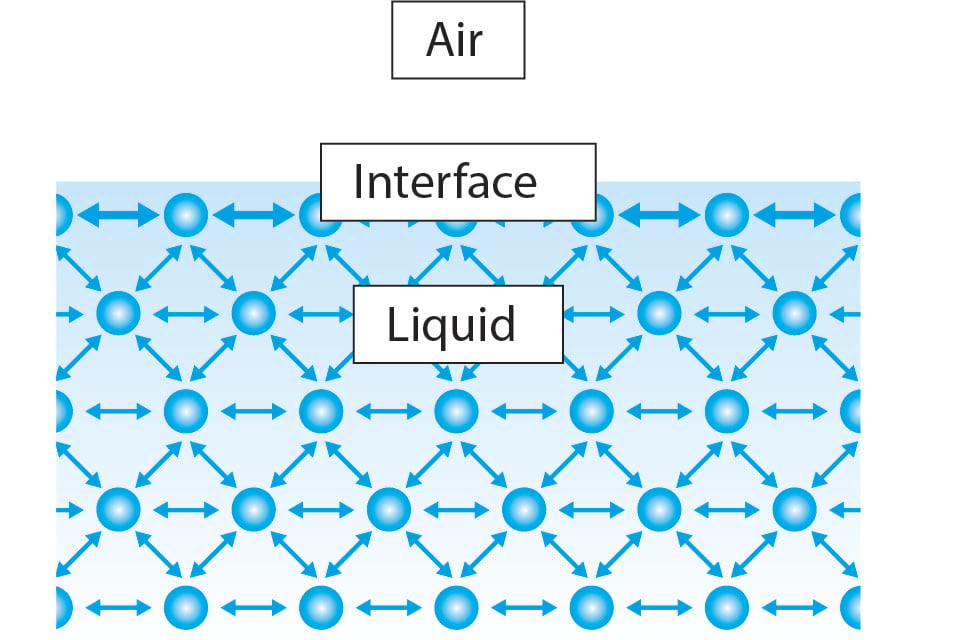
Având în vedere această explicație, este clar că toate lichidele vor avea aceeași proprietate, dar de ce tensiunea superficială a apei este mult mai mare decât etanolul, de exemplu.
Pentru a înțelege acest lucru, trebuie să ne gândim la legăturile dintre molecule. După cum sa explicat, forța de coeziune dintre molecule provoacă tensiune superficială. Cu cât forța de coeziune este mai puternică, cu atât tensiunea superficială este mai puternică. Molecula de apă are doi atomi de hidrogen legați de un atom de oxigen prin legături covalente. Datorită electronegativității ridicate a oxigenului, va avea o parte mare din sarcina negativă pe partea sa, în timp ce hidrogenul va fi încărcat mai pozitiv. Acest lucru determină o atracție electrostatică între atomul de hidrogen dintr-o moleculă și atomul de oxigen din alta. Legăturile formate sunt numite legături de hidrogen, ceea ce duce la forțe de coeziune puternice între moleculele de apă și tensiune superficială ridicată a apei.
Așa cum am menționat la începutul blogului, acest lucru explică și motivul pentru care mercurul are o tensiune superficială atât de mare. Deoarece mercurul este un metal, legăturile dintre molecule sunt legături metalice care sunt mult mai puternice decât legăturile de hidrogen, ducând la forțe de coeziune foarte mari și tensiune superficială ridicată.
Pentru a afla mai multe despre importanța tensiunii superficiale prin linkul de mai jos
