De oppervlaktespanning van water is ongeveer 72 mN / m bij kamertemperatuur, wat een van de hoogste oppervlaktespanningen is voor vloeistof. Er is maar één vloeistof met een hogere oppervlaktespanning en dat is kwik, een vloeibaar metaal met een oppervlaktespanning van bijna 500 mN / m. Waarom de oppervlaktespanning van kwik zo hoog is, zal ook duidelijk worden na het lezen van deze korte blogpost.
De hoge oppervlaktespanning van water wordt veroorzaakt door sterke moleculaire interacties
De oppervlaktespanning ontstaat door op samenhangende interacties tussen de moleculen in de vloeistof. Bij het grootste deel van de vloeistof hebben de moleculen aan elke kant naburige moleculen. Moleculen trekken elkaar in alle richtingen gelijkmatig en veroorzaken een netto kracht van nul. Aan het grensvlak hebben de vloeistofmoleculen echter slechts de helft van de aangrenzende vloeistofmoleculen in vergelijking met het grootste deel van de vloeistof. Hierdoor associeert het molecuul zich sterker met de moleculen aan zijn zijkanten en veroorzaakt een netto naar binnen gerichte kracht naar de vloeistof. Deze kracht weerstaat het breken van het oppervlak en wordt oppervlaktespanning genoemd.
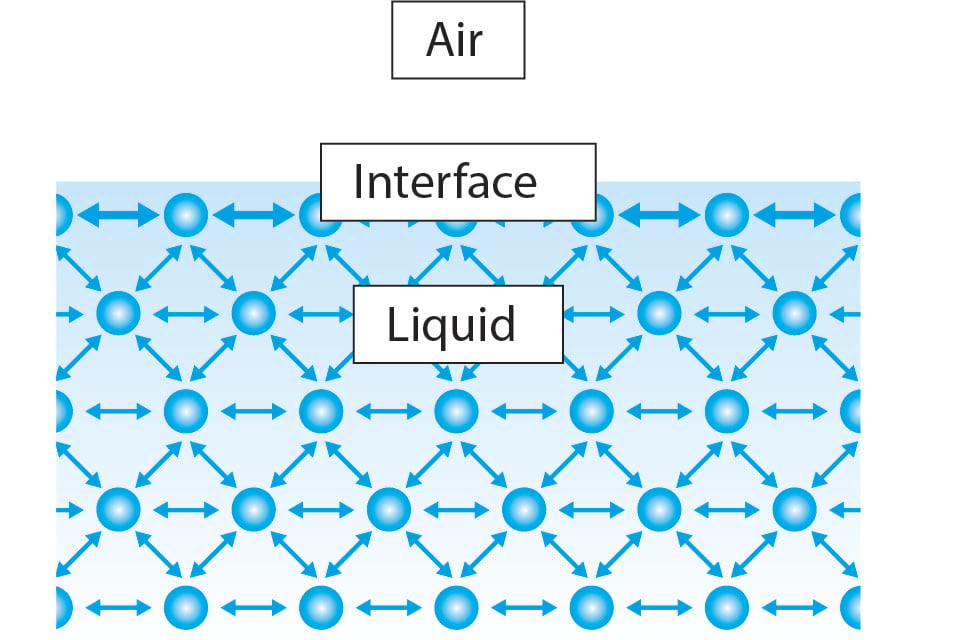
Met deze uitleg in gedachten is het dan duidelijk dat alle vloeistoffen zullen dezelfde eigenschap hebben, maar waarom de oppervlaktespanning van water veel hoger is dan bijvoorbeeld ethanol.
Om dit te begrijpen moeten we denken aan de bindingen tussen de moleculen. Zoals uitgelegd, veroorzaakt de cohesiekracht tussen de moleculen oppervlaktespanning. Hoe sterker de cohesiekracht, hoe sterker de oppervlaktespanning. Het watermolecuul heeft twee waterstofatomen die via covalente binding aan een zuurstofatoom binden. Vanwege de hoge elektronegativiteit van zuurstof zal het een groot deel van de negatieve lading op zijn kant hebben, terwijl waterstof positiever geladen zal zijn. Dit veroorzaakt een elektrostatische aantrekkingskracht tussen het waterstofatoom in het ene molecuul en het zuurstofatoom in het andere. Gevormde bindingen worden waterstofbruggen genoemd, wat leidt tot sterke cohesiekrachten tussen de watermoleculen en een hoge oppervlaktespanning van water.
Zoals vermeld aan het begin van de blog, verklaart dit ook waarom kwik zon hoge oppervlaktespanning heeft. Omdat kwik een metaal is, zijn de bindingen tussen de moleculen metaalbindingen die veel sterker zijn dan de waterstofbindingen, wat leidt tot zeer hoge cohesiekrachten en hoge oppervlaktespanning.
Om meer te leren over het belang van oppervlaktespanning door de onderstaande link
