水の表面張力は室温で約72mN / mであり、液体の表面張力の中で最も高いものの1つです。表面張力が高い液体は1つだけで、それは表面張力がほぼ500 mN / mの液体金属である水銀です。水銀の表面張力が非常に高い理由は、この短いブログ投稿を読んだ後で明らかになります。
水の表面張力が高いのは、強い分子相互作用が原因です
表面張力は液体中の分子間の凝集相互作用に。液体の大部分では、分子の両側に隣接する分子があります。分子はすべての方向で等しく互いに引っ張られており、正味の力はゼロになっています。ただし、界面では、液体分子は、液体の大部分と比較して、隣接する液体分子の半分しかありません。これにより、分子はその側面の分子とより強く結合し、液体に向かって正味の内向きの力を引き起こします。この力は表面の破壊に抵抗し、表面張力と呼ばれます。
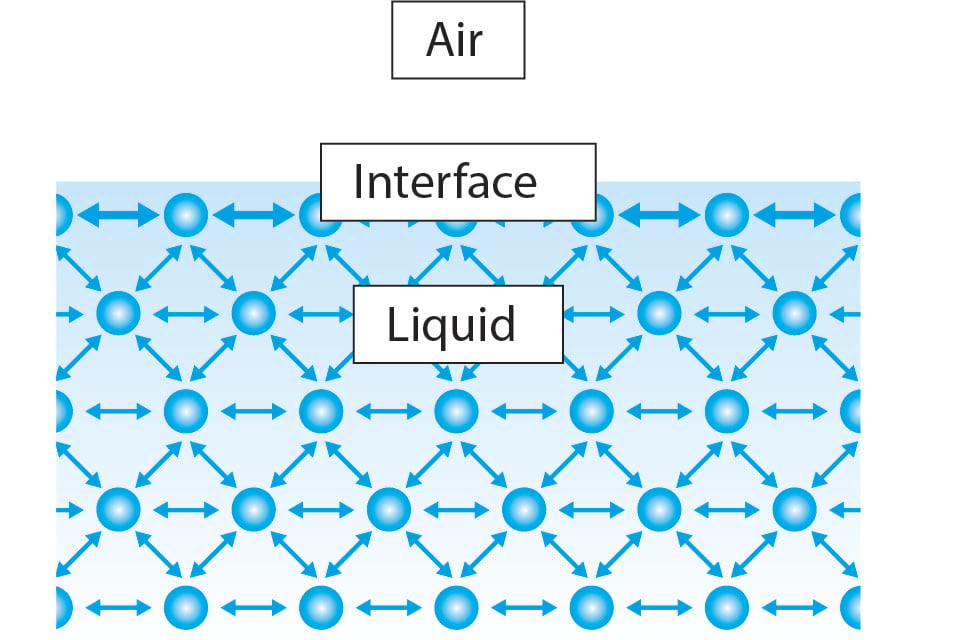
この説明を念頭に置くと、次のことが明らかになります。すべての液体は同じ特性を持ちますが、たとえば水の表面張力がエタノールよりもはるかに高いのはなぜですか。
これを理解するには、分子間の結合について考える必要があります。説明したように、分子間の凝集力は表面張力を引き起こします。凝集力が強いほど、表面張力が強くなります。水分子は、共有結合を介して酸素原子に結合する2つの水素原子を持っています。酸素の電気陰性度が高いため、負電荷の大部分が側面にありますが、水素はより正に帯電します。これにより、ある分子の水素原子と別の分子の酸素原子の間に静電引力が発生します。形成された結合は水素結合と呼ばれ、水分子間の強い凝集力と水の高い表面張力をもたらします。
ブログの冒頭で述べたように、これは水銀の表面張力が非常に高い理由も説明しています。水銀は金属であるため、分子間の結合は水素結合よりもはるかに強い金属結合であり、非常に高い凝集力と高い表面張力をもたらします。
表面張力の重要性について詳しく知るには以下のリンク
