Veden pintajännitys on noin 72 mN / m huoneenlämpötilassa, mikä on nesteen korkein pintajännitys. On vain yksi neste, jolla on suurempi pintajännitys, ja se on elohopea, joka on nestemäistä metallia, jonka pintajännitys on lähes 500 mN / m. Miksi elohopean pintajännitys on niin korkea, käy ilmi myös tämän lyhyen blogikirjoituksen lukemisen jälkeen.
Veden korkea pintajännitys johtuu voimakkaista molekyylivuorovaikutuksista.
Pintajännitys syntyy nesteessä olevien molekyylien välisiin yhtenäisiin vuorovaikutuksiin. Nesteen pääosassa molekyyleillä on molemmilla puolilla naapurimolekyylejä. Molekyylit vetävät toisiaan tasaisesti kaikkiin suuntiin aiheuttaen nollan nettovoiman. Rajapinnalla nestemolekyyleillä on kuitenkin vain puolet viereisistä nestemolekyyleistä suurimpaan osaan nestettä. Tämä saa molekyylin sitoutumaan voimakkaammin sen sivuilla oleviin molekyyleihin ja aiheuttaa nettoon sisäänpäin suuntautuvan voiman kohti nestettä. Tämä voima vastustaa pinnan murtumista ja sitä kutsutaan pintajännitykseksi.
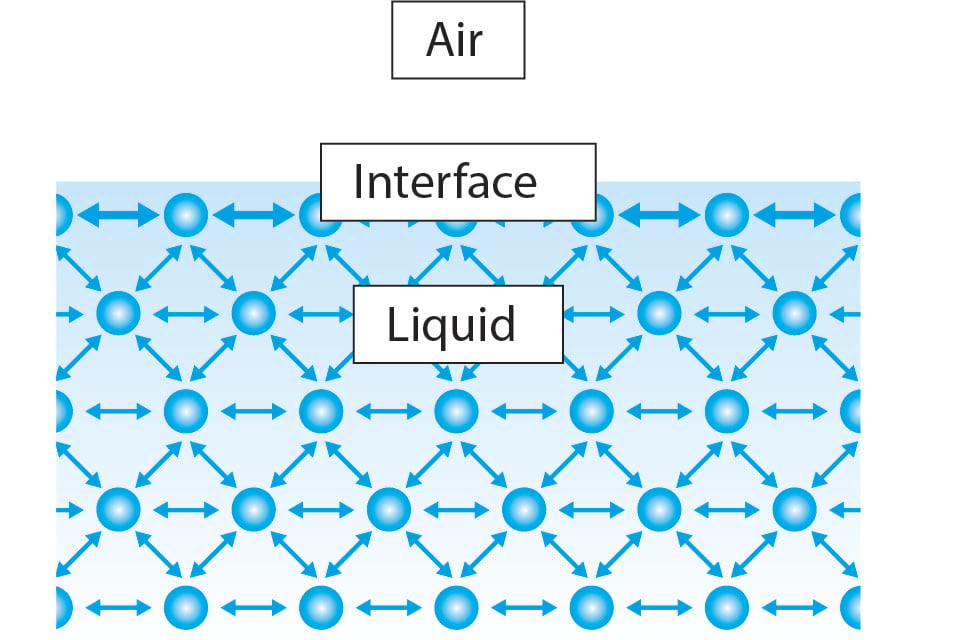
Tämän selityksen vuoksi on selvää, että Kaikilla nesteillä on sama ominaisuus, mutta miksi veden pintajännitys on paljon korkeampi kuin esimerkiksi etanolilla.
Tämän ymmärtämiseksi on ajateltava molekyylien välisiä sidoksia. Kuten selitettiin, molekyylien välinen yhteenkuuluvuusvoima aiheuttaa pintajännityksen. Mitä vahvempi koheesio voima, sitä vahvempi pintajännitys. Vesimolekyylissä on kaksi vetyatomia, jotka sitoutuvat happiatomiin kovalenttisen sidoksen kautta. Hapen korkean elektronegatiivisuuden takia sillä on suuri osa negatiivisesta varauksesta kyljellään, kun taas vety on varautunut positiivisemmin. Tämä aiheuttaa sähköstaattisen vetovoiman yhden molekyylin vetyatomin ja toisen happiatomin välillä. Muodostuneita sidoksia kutsutaan vetysidoksiksi, mikä johtaa voimakkaisiin yhteenkuuluvuusvoimiin vesimolekyylien välillä ja veden korkeaan pintajännitykseen.
Kuten blogin alussa mainittiin, tämä selittää myös miksi elohopealla on niin suuri pintajännitys. Koska elohopea on metalli, molekyylien väliset sidokset ovat metallisidoksia, jotka ovat paljon vahvempia kuin vetysidokset, mikä johtaa erittäin korkeisiin koossapitovoimiin ja korkeaan pintajännitykseen.
Lisätietoja pintajännityksen merkityksestä alla oleva linkki
